| Tema | El enlace iónico y covalente |
|---|---|
| Evidencia | |
| calificable? | 1 |
| Activo | 1 |
Propósito
Establece relación entre las fuerzas intermoleculares y las propiedades químicas de los compuestos elaborando esquemas representativos de moléculas de sustancias de uso cotidiano.
Motivación
¿Cómo se mantienen unidos los átomos?

Imagina por unos segundos el proceso de planeación y sincronía que fueron necesarios para llegar a conformar esta figura en el aire. ¿Qué relación tiene esta imagen con el tema de enlaces químicos?
Explicación
Se denomina enlace químico a las fuerzas atractivas que mantienen unidos los átomos de forma estable; es decir tiene lugar porque permite a los átomos que se enlazan alcanzar configuraciones electrónicas más estables.
Para que esto suceda, entre los átomos se producen transferencias de electrones de valencia- los electrones del nivel energético más externo.
Los átomos comparten, ceden o ganan electrones, estos electrones se conocen como electrones de valencia, porque son los que se ubican en el último nivel de energía.
Para identificar cuántos electrones de valencia tiene el átomo de un elemento, se puede observar en la tabla periódica; el número del grupo en el que se encuentra el elemento será la cantidad de electrones de valencia que tenga, así:
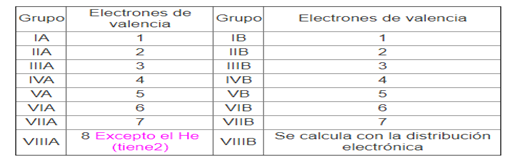
La clasificación de los grupos ha dejado atrás los números romanos y ahora se enumeran del 1 al 18, así:
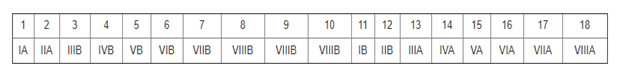
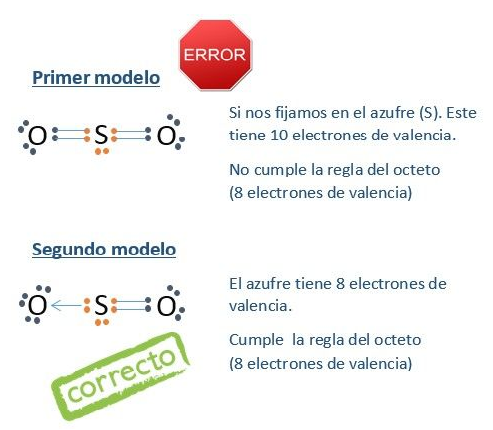
Algunos de los átomos forman enlaces para estabilizar su estructura, a esto se le llama la regla del octeto, esta regla indica que la mayoría de los átomos tienden a tener 8 electrones en su último nivel de energía, (excepto el H que solo tendría 2). Esta regla no se aplica a los elementos de transición pues pueden tener varios estados de oxidación, es más aplicable a los elementos del periodo 2.
En la naturaleza, solo algunos elementos se presentan como átomos libres y aislados. Estos son los gases nobles, elementos muy estables que no reaccionan con otros (en condiciones normales). Las demás sustancias químicas normalmente se encuentran enlazados químicamente con otros átomos: pueden unirse con átomos diferentes y formar compuestos (H2O, NaCl, etc.), o con átomos iguales, y así formar los elementos (O2, N2).
Los átomos se unen porque al enlazarse adquieren un estado de menor energía, lo que les da mayor estabilidad.
“Los átomos de los elementos químicos se enlazan para alcanzar una configuración electrónica externa similar a la del gas noble más cercano en la Tabla periódica”.
Enlace Iónico
Un enlace iónico se forma cuando hay transferencia de electrones entre un átomo metálico y un átomo no metálico, es decir entre un átomo poco electronegativo y otro muy electronegativo. Por ejemplo, el sodio (Na) es un metal cuya capa externa tiene un electrón. Este puede ser cedido fácilmente y quedar como catión Na+. En cambio, el cloro (Cl), tiene siete electrones en su capa externa, razón por la cual tiene una mayor predisposición para atraer un electrón y quedar con ocho electrones, lo que lo transforma en el anión cloruro Cl-.
Si se juntan en solución acuosa el sodio y cloro, sus cargas opuestas se atraen por fuerzas electrostáticas. Los compuestos formados de esta manera se arreglan en cristales.
Características generales de los cristales iónicos
En los enlaces iónicos, participan un catión y un anión.
Los compuestos iónicos forman sólidos cristalinos.
Presentan puntos de fusión altos debido a la fuerte atracción electrostática
No conducen electricidad en estado sólido, conducen electricidad cuando están disociados en solución.

Enlace Covalente
Los enlaces covalentes se forman entre átomos no metálicos del mismo elemento químico, entre átomos no metálicos de distintos elementos con una diferencia de electronegatividad menor o igual que 1,7.
La forma en que estas sustancias o compuestos químicos logran la estabilidad es compartiendo un par de electrones (uno procedente de cada átomo). De esta manera, el par de electrones compartido es común a los dos átomos y al mismo tiempo los mantiene unidos.
Existen fundamentalmente tres tipos de enlaces covalentes
Enlace covalente polar. Se forma entre átomos de distintos elementos químicos que tengan una diferencia de electronegatividad superior a 0,4. Los electrones del enlace son más atraídos por el átomo más electronegativo, y queda así una densidad de carga negativa sobre este átomo y una densidad de carga positiva sobre el átomo menos electronegativo. Debido a la distinta distribución de carga sobre la molécula, se genera un dipolo eléctrico. Por ejemplo: el enlace oxígeno-hidrógeno del agua
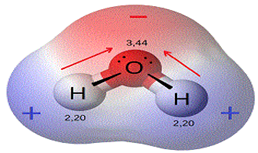
Enlace covalente apolar. Se forma entre átomos del mismo elemento químico o entre átomos con una diferencia de electronegatividad prácticamente despreciable. Por ejemplo: el enlace carbono-hidrógeno
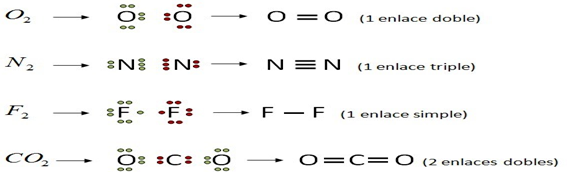
Puedes profundizar el concepto de polaridad observando el siguiente video:
Enlace covalente: polaridad de enlace y polaridad molecular
http://www.quimitube.com/videos/enlace-covalente-polaridad-de-enlace-y-polaridad-molecular.
Enlace covalente coordinado o dativo. Es un enlace covalente donde solo uno de los átomos que forman el enlace aporta el par de electrones compartido. Por lo general, para que se forme este tipo de enlace, uno de los átomos involucrados debe tener al menos un par de electrones libres (como en el caso del nitrógeno).
Observa el siguiente video sobre una experiencia de laboratorio y establece a partir de él las diferencias entre las soluciones de sustancias de carácter iónico y covalente.
Laboratorio sobre conductividad eléctrica
Ejercicios
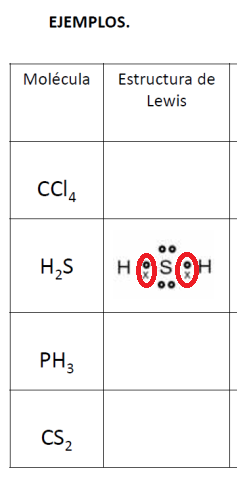
1.-Las siguientes moléculas presentan enlace covalente, indique las estructuras de Lewis para cada una de ellas.
2.- Los enlaces químicos, juegos de ciencias interactivos. https://www.cerebriti.com/juegos-de-ciencias/los-enlaces-qumicos-
Evaluación
1.-Indique que tipo de enlace se presenta entre los siguientes elementos e indique la estructura de Lewis o formula química electrónica y la formula estructural:
a. Cl y Hb. N y Nc. F y Lid. Ba y Se. O y O
Tenga en cuenta lo siguiente para responder las preguntas 2 y 3
En general, los diferentes valores de electronegatividad de los átomos determinan el tipo de enlace que se formará en la molécula que los combina. Así, según la diferencia entre las electronegatividades de éstos se puede determinar (convencionalmente) si el enlace será, según la escala de Linus Pauling:
Iónico (diferencia superior o igual a 1,7)
Covalente polar (diferencia entre 1,7 y 0,4)
Covalente no polar (diferencia inferior a 0,4)
Cuanto más pequeño es el radio atómico, mayor es la energía de ionización y mayor la electronegatividad y viceversa.
2.-Utilice los valores de la electronegatividad para predecir el tipo de enlace que se presenta entre los siguientes elementos:
a. Fe y Ob. H y Hc. K y Cl
3.-Clasifique las siguientes moléculas como polares o no polares:
a. F2b. O2c. HBrd. N2
4.-realice las estructuras de Lewis de las siguientes sustancias:
a. H2Sb. HClO4 c. CBr4d. Ke. Al2O3f. O3
Bibliografía
Hola Química I Editorial SUSAETA
Contextos Naturales 10, Química I. Editorial Voluntad
Investiguemos 10, Editorial Voluntad
Fuente: https://www.ejemplos.co/20-ejemplos-de-enlaces-covalentes/#ixzz6zqvXlnrP
Foro
Acceso a las actividades
| Actividad | Nombre | Fecha de ingreso | Fecha de actualización | Número de ingresos | Año | Curso | Subreporte |
|---|---|---|---|---|---|---|---|
No results found. | |||||||
