| Tema | Potencial de ionización, Electronegatividad y afinidad electrónica |
|---|---|
| Evidencia | |
| calificable? | 1 |
| Activo | 1 |
Propósito
Establece relación entre las propiedades físicas químicas de un elemento y su ubicación en la tabla periódica a partir de los números cuánticos utilizando para ello informes de laboratorio.
Motivación
¿Cuánto sabes sobre la tabla periódica?
Elementos. Todo está formado de elementos. Y se ordenan en una tabla según su naturaleza y propiedades. Conocerlos es conocer de que está hecho todo lo que te rodea. ¿Te atreves a ponerte a prueba con este test?
https://www.nationalgeographic.com.es/ciencia/cuanto-sabes-sobre-tabla-periodica_14032/2
Explicación
PROPIEDADES PERIODICAS DE LOS ELEMENTOS QUÍMICOS
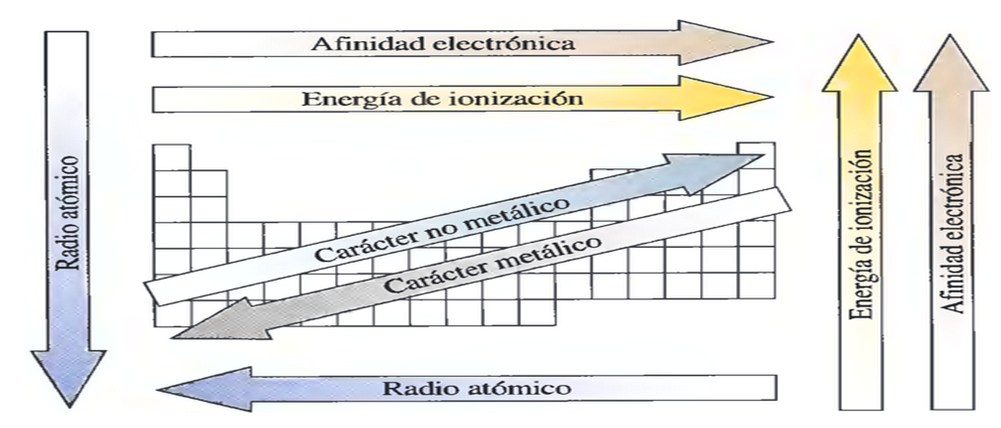
RADIO ATÓMICO
a) Es relativo
b) Depende de:
- N.º de niveles energéticos: a mayor "n" mayor volumen, por lo tanto, aumenta al bajar en un grupo.
- Número atómico "Z": cuanto mayor sea Z, en un mismo periodo, habrá mayor atracción entre protones y electrones y el átomo se contrae.
- Disminuye de izquierda a derecha en un periodo y en un grupo de arriba hacia abajo

ENERGÍA O (potencial) DE IONIZACIÓN
Es la cantidad de energía que se requiere para arrancar un electrón del nivel más externo de dicho átomo en estado gaseoso.
Así, la energía de ionización varía en sentido contrario a la variación del radio atómico. En un mismo periodo, la energía de ionización aumenta hacia la derecha, mientras que, en un mismo grupo, aumenta hacia arriba. En esencia, la energía de ionización aumenta hacia arriba y hacia la derecha.
AFINIDAD ELECTRÓNICA
Es la cantidad de energía que se desprende cuando capta un electrón un átomo neutro, gaseoso y en estado elemental, dando así un anión.
ELECTRONEGATIVIDAD
es básicamente una medida que demuestra la capacidad que ostenta un átomo de atraer para sí los electrones que corresponden a otro átomo cuando ambos conforman un enlace químico.
Los gases nobles o inertes, Grupo VIIIA quedan excluidos de esta tendencia, ya que su electronegatividad es prácticamente nula, debido a su dificultad para formar enlaces covalentes, ya que, al tener la última capa completa, no tienen tendencia ni a ganar ni a perder electrones.
Ejercicios
Nombres químicos https://www.cerebriti.com/juegos-de-ciencias/nombres-quimicos
La tabla periódica ½ https://www.cerebriti.com/juegos-de-ciencias/la-tabla-periodica-1-2
Evaluación
1.-Dados los elementos F, P, Cl y Na, ordénalos de forma creciente en función de:
a) Sus radios atómicos.
b) Primera energía de ionización.
c) Electronegatividad.
- Recuerde que estos valores se cuantifican y se encuentra la información en la tabla periódica para cada elemento químico.
Ver video para aclarar dudas http://www.quimitube.com/videos/ordenacion-de-elementos-quimicos-segun-su-energia-de-ionizacion
2.-Dados los elementos C (Z = 6), Na (Z = 11) y Cl (Z = 17):
A) Escribe sus configuraciones electrónicas en estado fundamental.
B) Indica cuál sería su situación en la tabla periódica (grupo y período) así como el orden creciente de electronegatividad.
- Recuerde que estos valores se cuantifican y se encuentra la información en la tabla periódica para cada elemento químico.
3.-Determine cual es elemento mas electronegativo y el menos electronegativo de la tabla periódica.
4.-Curiosidades
-Cuál es el único metal liquido?
-Cuál es el elemento más dúctil y maleable
-Cuál es el elemento considerado el mejor conductor de electricidad
-Cuál es el elemento considerado el mejor conductor de calor
-Selecciona un elemento que los científicos consideran radiactivo y explica en que consiste esta propiedad de algunos elementos químicos y cuál es la utilidad que el ser humano le ha dado.
Bibliografía
-Hola Química I. Editorial Susaeta
-Contextos naturales. Química I. Editorial Santillana
-Química 10. Editorial Voluntad
Foro
Acceso a las actividades
| Actividad | Nombre | Fecha de ingreso | Fecha de actualización | Número de ingresos | Año | Curso | Subreporte |
|---|---|---|---|---|---|---|---|
No results found. | |||||||
