| Tema | El Carbono |
|---|---|
| Evidencia | |
| calificable? | 1 |
| Activo | 1 |
Propósito
Explica las diferencias entre los compuestos inorgánicos y orgánicos en términos de sus propiedades físicas, propiedades químicas y nomenclatura para determinar la importancia de la química orgánica en la vida cotidiana del ser humano.
Motivación
¿Por qué es importante el estudio de los compuestos que hacen parte de los seres vivos?
Observa este video para complementar tu respuesta https://www.youtube.com/watch?v=N0GwGJFpYRM

Explicación
EXPLICACIÓN
La química orgánica es la rama de la química que se dedica al estudio de compuestos de carbono, como limpiadores, plásticos, aditivos alimentarios y medicamentos. Es muy importante, ya que tiene mucho que ver con nuestra vida diaria, como ya te lo pudiste imaginar, abarcando desde nuestra vestimenta hasta la aspirina que nos quita el dolor de cabeza.
ESTRUCTURA DEL ATOMO DEL CARBONO
El carbono presenta propiedades químicas especiales que le permiten que sus átomos puedan unirse entre sí mismos formando infinidad de estructuras químicas cuyo arreglo geométrico puede ser lineal, ramificado o cíclico.
El carbono en su estado fundamental distribuye sus electrones de la siguiente manera: 1s2 2s2 2p2.
La Regla de Hund afirma que "para cualquier conjunto de orbitales, tal como el caso de los orbitales 2p, se encuentra que hay un electrón en cada orbital antes que haya un apareamiento".
El carbono muestra en su estado fundamental dos electrones de esta clase y en consecuencia su capacidad de enlace es de dos. Así se comporta cuando forma compuestos como el monóxido de carbono, CO.
Sin embargo, en los compuestos orgánicos, el carbono no forma dos sino cuatro enlaces, lo cual significa que debe poseer cuatro electrones desapareados. ¿Cómo hace el carbono para cumplir tal requisito?
Para dar respuesta a la interrogante anterior, el químico Linus Pauling formuló la teoría de la hibridación.
Dicha teoría afirma que: "en el momento de combinarse, los átomos alcanzan un estado de excitación, como consecuencia de la energía que ganan. En tal estado, algunos electrones saltan de un orbital inferior a uno inmediatamente superior".
Estado excitado
del carbono
Para el carbono, debemos suponer que el electrón del orbital 2s salta al orbital 2pz que en el estado fundamental se encontraba vacío quedando la siguiente estructura.

La solución para el dilema es aceptar la formación de orbitales híbridos mezclados: el electrón del orbital 2s y los tres electrones de los orbitales 2p, sumarían sus energías y la redistribuirían entre sí por partes iguales. híbridos sp3.
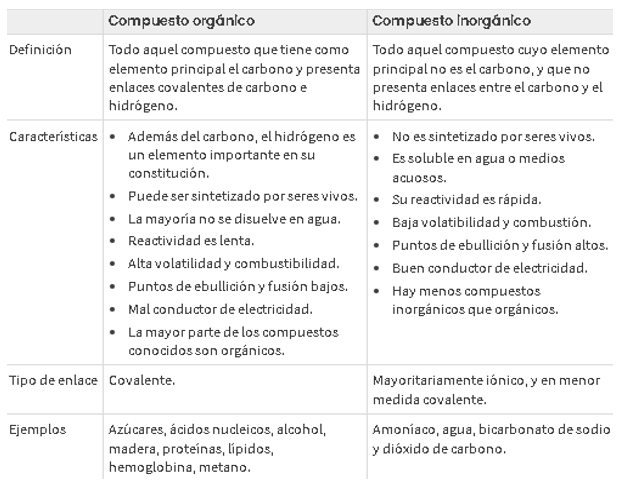
Establecida la forma que presenta un orbital híbrido sp3, conviene examinar qué orientación tienen en el espacio. Los investigadores han establecido que los cuatro orbitales híbridos sp3 del átomo de carbono están dirigidos hacia los cuatro vértices de un tetraedro regular, en cuyo punto central se ubicaría el núcleo del átomo.
La hibridación tetraedrica le permite al carbono formar enlaces sencillos. Por ejemplo, en el metano (CH4), el carbono tiene cuatro electrones disponibles para formar enlaces y cada hidrógeno un electrón.
Se puede observar que los cuatro orbitales sp3 se dirigen hacia los vértices de un tetraedro y hace que cada ángulo de enlace sea de 109.5 grados.
Hoy en día se conocen más de 3 millones de compuestos del carbono o compuestos orgánicos y el número aumenta, esto se explica por la propiedad que tienen los átomos de carbono de formar cadenas unos con otros como consecuencia de formar cada átomo de carbono 4 enlaces covalentes para cumplir la ley del octeto.
Clasificación de compuestos orgánicos
En todas las moléculas orgánicas se puede identificar una estructura básica, en la cual un armazón central, constituido por una cadena de carbonos, soporta un cierto número de átomos de otros elementos.
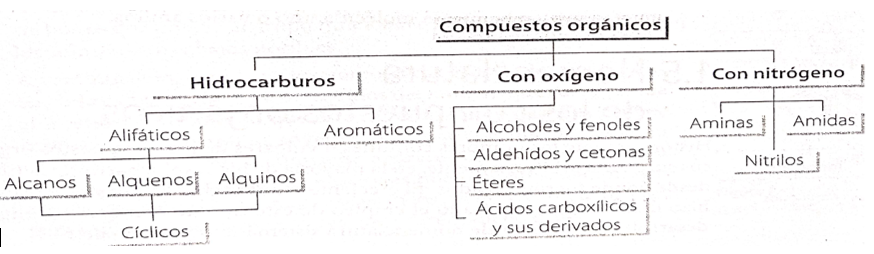
1.-Los hidrocarburos alifáticos
Son los compuestos orgánicos más simples ya que están constituidos únicamente por carbono e hidrogeno.
Se obtienen principalmente del petróleo y el gas natural.
Se utilizan principalmente como combustible pero también se utilizan extensamente como materia prima en la manufactura de numerosos productos tales como drogas, plásticos, cauchos, resinas, etc.
De acuerdo con su estructura, los hidrocarburos pueden ser de cadena abierta -alifáticos (normal o ramificada 0 cíclicos.
Según el tipo de enlaces presente, los hidrocarburos se conocen como saturados o insaturados.
üHidrocarburos saturados:aquellos cuyas moléculas contienen únicamente enlaces simples carbono-carbono.
üHidrocarburos insaturados: la molécula presenta por lo menos un enlace (doble o triple.
Los hidrocarburos alifáticos se dividen en tres grupos, los alcanos, alquenos y alquinos.
- a.Los alcanos:
Los alcanos también se llaman parafinas, son hidrocarburos saturados de cadena abierta que tienen enlaces sencillos: C-C y C-H. Su fórmula general es: Cn H2n+2
Los alcanos también se llaman parafinas, son hidrocarburos saturados de cadena abierta que tienen enlaces sencillos: C-C
Los cuatro primeros son gases, los que tienen de cinco a quince átomos de carbonos, son líquidos y los de dieciséis en adelante son sólidos.
El punto de fusión, de ebullición y la densidad aumentan conforme aumenta el número de átomos de carbono.
Son insolubles en agua y disolventes polares, pero solubles en solventes no polares como, el benceno y el tetracloruro de carbono.
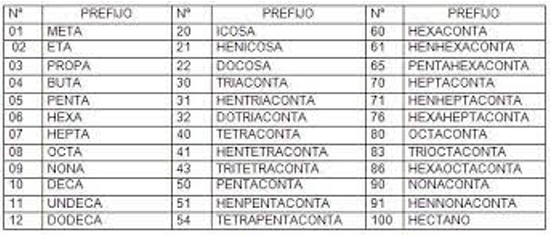
Nomenclatura IUPAC de alcanos.
La Unión Internacional de Química Pura y Aplicada (IUPAC), relaciona los nombres de los compuestos con su estructura molecular.
Los compuestos que contienen solo carbono e hidrógeno, de cadena continua, no ramificada y con enlace sencillo
(alcanos), se designa de acuerdo con el nombre griego que corresponde al número de carbonos seguido del sufijo –ano.
En la siguiente tabla se presentan los nombres de los primeros diez hidrocarburos de cadena continua.
Para representar los hidrocarburos se utilizan tres tipos de fórmulas:
1. Condensada o molecular: indica solo el número total de átomos de cada elemento del compuesto, por ejemplo, C4H10.
2. Semidesarrollada: cada átomo de carbono se escribe junto con sus respectivos átomos de hidrógeno (expresados en subíndices), indica únicamente las uniones entre los átomos de carbono. Ejemplo CH3-CH2- CH3.
3. Desarrollada: representa todos los enlaces presentes entre los átomos, que forman la molécula.
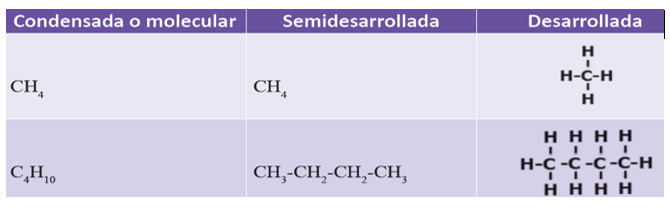
En la siguiente tabla se presenta la fórmula estructural y los nombres de los primeros cinco hidrocarburos de cadena continua
Nomenclatura de alcanos de cadena ramificada.
Los alcanos de cadenas ramificadas son cadenas que tienen cadenas de carbonos unidas a ellas llamadas grupos alquilo.
Los grupos alquilo, resultan de quitar un hidrógeno a un alcano y se nombran cambiando la terminación del nombre del hidrocarburo apropiado de –ano a –ilo.
Los grupos alquilo más utilizados son:

Reglas para nombrar alcanos aplicando el sistema IUPAC.
- üSeleccionar la cadena más larga de átomos de carbono, la cual será la cadena principal y nos dará el nombre básico del compuesto.
- üNumera la cadena empezando por el extremo más cercano a una ramificación. En dado caso que se presenten dos sustituyentes a la misma distancia de los extremos, el orden alfabético será quien determine por qué extremo se numera la cadena.
- üSe nombra cada uno de las ramificaciones, por orden alfabético, indicando su posición con el número que corresponda al átomo de carbono al cual se encuentra unido. Si en la molécula se encuentran dos o más veces el mismo radical, se indica con los prefijos di-(2), tri-(3), tetra-(4), etc., anteponiéndolos al nombre del radical.
- üPor último, se da el nombre del alcano correspondiente, al número de carbonos presentes en la cadena principal.
Los números se separan de los nombres por guiones y los números entre sí por comas.
Ejemplo 1

Isomería.
La isomería es un fenómeno que consiste en que dos o más compuestos tienen la misma fórmula molecular, pero distintas estructuras moleculares.
Se llaman isómeros a moléculas que tienen la misma fórmula molecular pero distinta estructura. En otras palabras, misma fórmula molecular pero distinta fórmula desarrollada y diferentes propiedades físicas y químicas.
Cn H2n+2C4 H10

Propiedades químicas
a. Combustión de alcanos
Cuando se somete un alcano al calor generado por una llama, estos reaccionarán con el oxígeno atmosférico para producir dióxido de carbono (gaseoso) y agua (líquido).
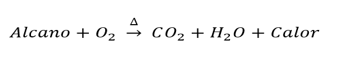
Cuando un alcano se encuentra en presencia de luz ultravioleta o es calentado por encima de los 300 °C reaccionarán con halógenos como el Cl o el Br para producir mezclas de derivados halogenados y desprendiendo halogenuros de hidrógeno. Por ejemplo: Cloración del metano
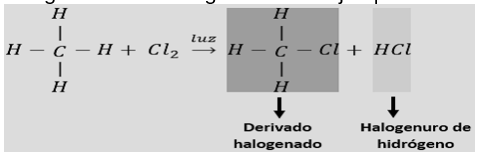
Cada hidrógeno del alcano puede ser sustituido por un halógeno, en este caso cloro. La luz UV provee la energía para que se desarrolle la reacción.
Pirólisis o Cracking
Descomponer una sustancia por la mera acción del calor se denomina pirólisis. La pirólisis de alcanos, en particular al petróleo, se conoce como cracking.
Es un procedimiento que consiste en hacer pasar los alcanos de alto peso molecular por una cámara a temperaturas elevadas, entre 400 °C y 600 °C, para convertirlos en alcanos más livianos, alquenos (como eteno) e hidrógeno.

Ejercicios
1.- Realiza la configuración electrónica de los siguientes átomos, y determina su nivel de valencia y sus electrones de valencia.
6C
¿Cuántos electrones en total tiene este átomo? __________
¿Cuál es su nivel de valencia? __________
¿Cuántos electrones de valencia tiene? ____________
Escribe la fórmula de la estructura de Lewis del elemento anterior
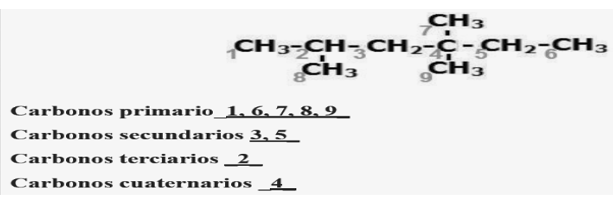
2.-De las siguientes estructuras, identifica, los tipos de carbono y coloca el número del carbono presente en cada estructura en el lugar que corresponda
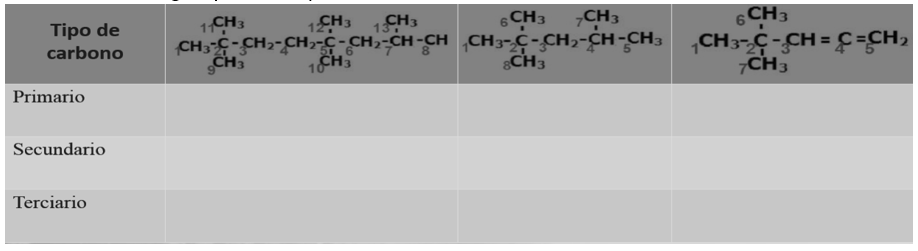
Evaluación
1.- Determina el nombre de cada uno de los siguientes hidrocarburos alifáticos satyrados (alcanos )
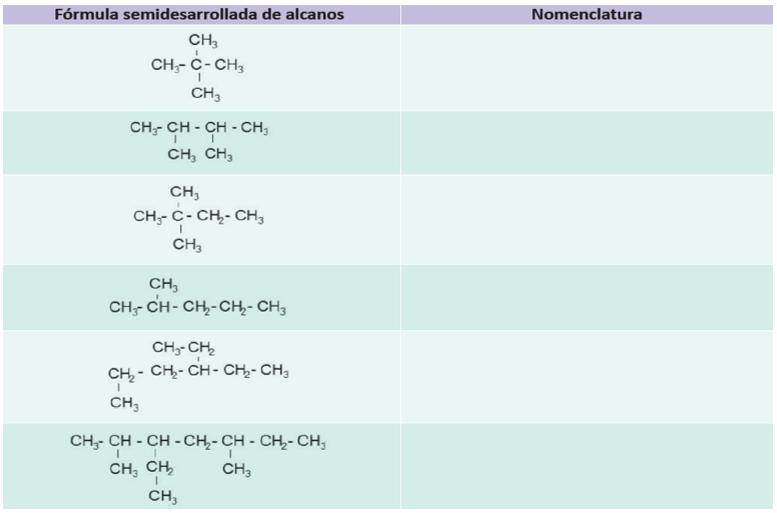 5 H10
5 H10
Bibliografía
Hola Química. Editorial Susaeta
HIPERTEXTO 2 química. Santillana
Foro
Acceso a las actividades
| Actividad | Nombre | Fecha de ingreso | Fecha de actualización | Número de ingresos | Año | Curso | Subreporte |
|---|---|---|---|---|---|---|---|
No results found. | |||||||
