| Tema | Reacciones y ecuaciones químicas |
|---|---|
| Evidencia | Fotografías de los talleres de los estudiantes, llamado a lista, vídeos, listas de chequeo y asistencia, llamado a padres de familia, grupos de WhatsA |
| calificable? | 1 |
| Activo | 0 |
Propósito
GUÍA # 3:
Que el estudiante comprenda los conceptos de reacción química y ecuaciones químicas y realice ejercicios practicos sobre el tema.
Motivación
Vamos a experimentar:
- 1.¿Cuáles beneficios aportan las reacciones químicas al ser humano?
- 2.En tu casa realiza el siguiente experimento, observa, analiza, describe. Para este experimento debes entregar un informe donde incluyas fotografía de todo el proceso:
Materiales:
- Huevos crudos de gallina.
- Vinagre.
- Frasco de cristal.
Procedimiento:
Toma un huevo de gallina y sumérgelo en un frasco que contenga vinagre, tapa dicho frasco para evitar el olor poco agradable. Observa que sucede con el experimento durante dos días y describe lo que sucede, (fotografía cada cambio que observes).
Preguntas:
- a)¿Qué crees que produce el olor poco agradable?
- b)¿Qué crees que sucede con la cascara del huevo?
- c)¿Qué función tiene el vinagre?
- d)¿Qué otro tipo de cambios observas?
- e)Escribe la reacción química que se lleva a cabo entre la cascara del huevo y el vinagre.
Explicación
ECUACION QUIMICA
Una ecuación química es una descripción simbólica de una reacción química. Muestra las sustancias que reaccionan (reactivos o reactantes) y las sustancias o productos que se obtienen. También nos indican las cantidades relativas de las sustancias que intervienen en la reacción. Las ecuaciones químicas son el modo de representarlas.
Se utilizan para describir lo que sucede en una reacción química en sus estados inicial y final. En ella figuran dos miembros; en el primero, los símbolos o fórmulas de los reactantes, reaccionantes o reactivos y en el segundo los símbolos o fórmulas de los productos. Para separar ambos miembros se utiliza una flecha que generalmente se dirige hacia la derecha, indicando el sentido de la reacción.
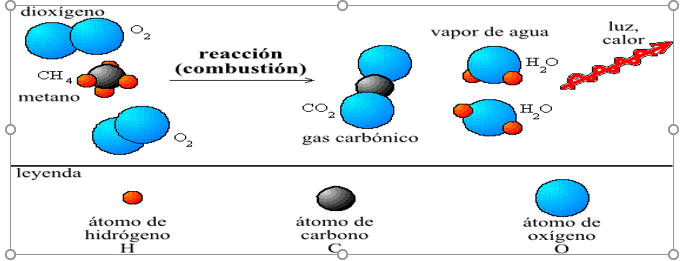
INTERPRETACION DE UNA ECUACION QUIMICA:
Un caso general de ecuación química sería:
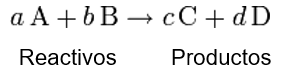
Dónde:
- §A, B, C, D, representan los símbolos químicos de las moléculas o átomos que reaccionan (lado izquierdo) y los que se producen (lado derecho).
- §a, b, c, d, representan los coeficientes estequiométricos, que deben ser ajustados de manera que sean reflejo de la ley de conservación de la masa.
El símbolo "+" se lee como "reacciona con", mientras que el símbolo "?" significa "irreversible" o "produce". Para ajustar la ecuación, ponemos los coeficientes estequiométricos.
Las fórmulas químicas a la izquierda de "?" representan las sustancias de partida, denominadas reactivos o reactantes; a la derecha de "?" están las fórmulas químicas de las sustancias producidas, denominadas productos.
Una ecuación química nos brinda información cuantitativa y cualitativa:
La interpretación cuantitativa de los coeficientes estequiométricos, puede ser en átomos o moles:
- 1.En átomos: Cuando "a" átomos (o moléculas) de A reaccionan con "b" átomos (o moléculas) de B producen "c" átomos (o moléculas) de C, y "d" átomos (o moléculas) de D.
- 2.En moles: Cuando "a" moles de átomos (o moléculas) de A reaccionan con "b" moles de átomos (o moléculas) de B producen "c" moles de átomos (o moléculas) de C, y "d" moles de átomos (o moléculas) de D.
La interpretación cualitativa nos brinda información de los tipos de funciones químicas, los símbolos y fórmulas de los reactivos y productos. Adicionalmente, se pueden agregar (entre paréntesis y como subíndice) el estado de cada sustancia participante: sólido (S), líquido (l), acuoso (Ac) O gaseoso (g).
BALANCEO DE ECUACIONES QUÍMICAS
Las ecuaciones químicas deben balancearse para cumplir con la ley de la conservación de la masa, que dice, “La cantidad de masa y energía presente en una reacción química permanece constante antes y después del proceso”.
Las ecuaciones químicas permiten conocer cuáles son las sustancias que se combinan para formar productos, esto quiere decir las que se forman. En la ecuación química el número de reactivos que se obtiene debe ser la misma cantidad que de productos.
Balancear una ecuación es buscar que el número de átomos en el primer miembro con los del segundo se obtenga una igualdad por lo que es importante el uso de coeficientes, pero nunca se deberá alterar los subíndices numéricos de las fórmulas o símbolos químicos.
Balanceo de ecuaciones químicas por el método de tanteo:
Para el balanceo de ecuaciones por el método de tanteo es importante conocer la Ley de la conservación de la masa que se enuncia del siguiente modo:
“En una reacción química, la suma de las masa de las sustancias reaccionantes es igual a la suma de las masas de los productos de la reacción”.
Para igualar ecuaciones por este método han de compararse uno a uno los distintos elementos que figuran en la reacción. Ejemplo:
Antes de balancear la ecuación:
KClO3 (s) ----------> KCl (s) + O2 (g)
(Clorato de potasio --------> cloruro de potasio + oxígeno)
Después de ser balanceada la ecuación:
2 KClO3 (s)> 2 KCl (s) + 3 O2 (g)
BALANCEO DE ECUACIONES POR EL MÉTODO DE REDOX (OXIDOREDUCCIÓN O REDOX):
En una reacción si un elemento se oxida, también debe existir un elemento que se reduce.
Recordar que una reacción de oxidación reducción no es otra cosa que una perdida y ganancia de electrones (e-), es decir, desprendimiento o absorción de energía (presencia de luz, calor, electricidad, etc.).
OXIDACIÓN: Es cualquier cambio químico en donde se presenta un aumento en el número de oxidación por la pérdida de electrones.
REDUCCIÓN: Es cualquier cambio químico en donde se presenta una disminución en el número de oxidación por la ganancia de electrones.
La sustancia oxidada es aquella que contiene el átomo que aumenta su número de oxidación. La sustancia oxidada actúa como agente reductor.
La sustancia reducida es aquella que contiene el átomo que disminuye su número de oxidación. La sustancia reducida actúa como agente oxidante
Para balancear una reacción por este método, se deben considerar los siguientes pasos:
Fe+O2--------->Fe2 O3

BALANCEO POR EL MÉTODO IÓN ELECTRON
El método de ión electrón o de las semiecuaciones utilizado para las ecuaciones iónicas y el método del cambio en el número de oxidación que se puede usar tanto en ecuaciones iónicas como en ecuaciones totales (moleculares). Para balancear la siguiente ecuación:

Ejercicios
1. Determine qué tipo de reacción es, para las siguientes reacciones:
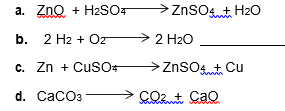
- 2.Escriba las formulas empírica, molecular y semiestructura de 5 compuestos que encuentres en tu casa, escribir su función y en que producto lo hallaste.
- 3.¿Qué pasa con las partículas de los reactivos cuando se transforman en productos?
- 4.¿Puedes identificar algunas reacciones químicas identificándolas como redox que ocurran a tu alrededor? Descríbelas.
Evaluación
1. entregar el informe del experimento de la motivación con fotografías.
2. Investiga en diferentes fuentes bibliográficas sobre los agentes oxidantes y agentes reductores y proponga mínimo 5 ejemplos de cada uno.
3. Elaborar una lista de materiales de uso común en la casa que contengan sustancias que, a su vez, sean buenos oxidantes o reductores.
4.¿Cómo relacionarías las reacciones redox con estos personajes?
- a.Alejandro Volta.
- b.Michael Faraday.
- c.Gastón Planté.
- d.Luigi Galvani
- e.George Leclanché.
Además:

Bibliografía
https://contenidosparaaprender.colombiaaprende.edu...
Foro
Cursos
| Curso | |
|---|---|
No results found. | |
Acceso a las actividades
| Actividad | Nombre | Fecha de ingreso | Fecha de actualización | Número de ingresos | Año | Curso | Subreporte |
|---|---|---|---|---|---|---|---|
No results found. | |||||||
