| Tema | Soluciones químicas |
|---|---|
| Evidencia | Fotografías de los talleres de los estudiantes, llamado a lista, vídeos, listas de chequeo y asistencia, llamado a padres de familia, grupos de WhatsA |
| calificable? | 0 |
| Activo | 1 |
Propósito
Que el estudiante comprenda el concepto de soluciones químicas, y realice ejercicios practicos relacionados al tema.
Motivación
Observa y explica la siguiente imagen:
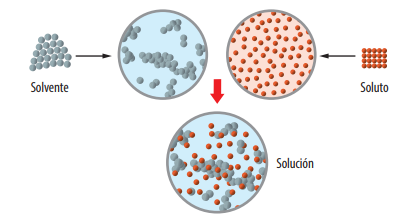
Explicación
LAS SOLUCIONES QUÍMICAS (TEXTOS ADEPATADOS DE COLOMBIA APRENDE-MEN)
Recuerde que… Las soluciones químicas son mezclas homogéneas, es decir presentan una sola fase. Las soluciones son la mezcla de un soluto y un solvente; el soluto es la sustancia disuelta y el solvente es el medio donde se dispersa. El solvente generalmente es la sustancia que se encuentra en mayor cantidad. Cuando el agua es uno de los componentes, se considera que es el solvente, aun cuando se encuentre en menor cantidad.
CONCEPTOS A TENER EN CUENTA:
Mezclas homogéneas (una sola fase) con composiciones variables. Resultan de la mezcla de dos o más sustancias puras diferentes cuya unión no produce una reacción química sino solamente un cambio físico. Una sustancia (soluto) se disuelve en otra (solvente) formando una sola fase. Los componentes pueden separarse utilizando procedimientos físicos.
MEZCLAS: Mezclas heterogéneas (más de una fase). Resultan de la mezcla de dos o más sustancias puras diferentes cuya unión no produce una reacción química sino solamente un cambio físico.
FASE: Porción de materia con propiedades uniformes. Porción de un sistema separado de los otros por límites físicos.
SOLUTO: Componente de una solución que se encuentra en cantidad menor. Es la fase de menor proporción.
SOLVENTE: Componente de una solución que se encuentra en cantidad mayor.
Es la fase de mayor proporción.
SOLUCIÓN ACUOSA: El solvente es el agua. El soluto puede ser un sólido, un líquido o un gas.
TIPOS DE SOLUCIONES:
- -Gas en líquido.
- -Líquido en líquido.
- -Sólido en líquido.
- -Gas en gas.
- -Líquido en gas.
- -Sólido en gas.
- -Gas en sólido.
- -Líquido en sólido.
- -Sólido en sólido.
SOLUBILIDAD: Cantidad máxima de soluto que puede ser disuelta por un determinado solvente. Varía con la presión y con la temperatura. Es un dato cuantitativo.
MISCIBILIDAD: Capacidad de una sustancia para disolverse en otra. Es un dato cualitativo. Separa los pares de sustancias en "miscibles" y "no miscibles".
CURVA DE SOLUBILIDAD: Representación gráfica de la solubilidad de un soluto en determinado solvente (eje y) en función de la temperatura (eje x).
SOLUCIÓN SATURADA: Solución que contiene la máxima cantidad de soluto que el solvente puede disolver a esa presión y esa temperatura. Si se le agrega más soluto no lo disuelve: si es un sólido en un solvente líquido, el exceso precipita; si es un líquido en solvente líquido, el exceso queda separado del solvente por encima o por debajo según su densidad relativa;si es un gas en un solvente líquido, el exceso de soluto escapa en forma de burbujas. En una solución saturada de un sólido en un líquido, el proceso de disolución tiene la misma velocidad que el proceso de precipitación.
SOLUCIÓN NO SATURADA: Solución que contiene una cantidad de soluto menor que la que el solvente puede disolver a esa presión y esa temperatura.
CARACTERÍSTICA GENERAL DE LA SOLUBILIDAD: Como ya fuera descubierto hace varios siglos, "lo similar disuelve a lo similar". Las sustancias iónicas son solubles en solventes iónicos. Las sustancias covalentes son solubles en solventes covalentes.
CASO PARTICULAR. SOLUCIONES DE GASES EN LÍQUIDOS: La solubilidad de un soluto gaseoso en un solvente líquido depende de cuatro factores: a) temperatura; b) presión; c) energía; y d) entropía. Se aplica la llamada "Ley de Henry" que permite conocer la presión parcial del soluto gaseoso en función de su fracción molar y de una constante que depende del gas y de su temperatura.
FACTORES QUE INFLUYEN EN LA VELOCIDAD DE DISOLUCIÓN: a)
tamaño de las partículas del soluto; b) naturaleza física del soluto; c) naturaleza física del solvente; d) temperatura; y e) grado de agitación del soluto y del solvente.
MÉTODOSDESEPARACIÓNDEMEZCLASHOMOGÉNEASY
HETEROGÉNEAS: Existen numerosos métodos, la mayoría adaptados a casos especiales de solutos y solventes determinados, bajo condiciones determinadas. Son los métodos generales más utilizados:
- -Disolución (sólido de sólido - uno soluble y el otro no).
- -Maceración (sólido de sólido - trituración + disolución).
- -Extracción (sólido de sólido - en frío con Soxhlet o en caliente por decocción).
- -Lixiviación (sólido de sólido - disolución con arrastre).
- -Tamizado (sólido de sólido - a través de mallas de alambre de distintos diámetros).
- -Destilación (líquido de líquido - homogénea - por diferencia en el punto de ebullición entre ambos).
- -Decantación (líquido de líquido - heterogénea - por diferencia entre la densidad de ambos).
- -Evaporación (sólido de líquido - homogénea - se calienta para evaporar el solvente y queda el soluto).
- -Cristalización (sólido de líquido - homogénea - se baja la temperatura para que cristalice el sólido - luego se filtra o decanta).
- -Filtración (sólido de líquido - heterogénea - se hace pasar a través de un filtro que retenga el sólido pero no el líquido).
- -Centrifugación (sólido de líquido - homogénea - se aumenta la aceleración de la gravedad por aumentar la fuerza centrífuga, facilitando la precipitación del sólido).
- -Cromatografía (todos los casos - homogénea - se usa una fase móvil y una fija, la móvil viaja sobre la fija y sus componentes se van separando según su facilidad de migración, la que depende de diversos factores, por ejemplo su peso molecular).
EXPRESIÓN DE LAS CONCENTRACIONES DE LAS SOLUCIONES:
Concentración: cantidad de soluto disuelto en una determinada cantidad de solvente, o cantidad de soluto disuelto en una determinada cantidad de solución. Siempre indica una proporción entre soluto y solvente.
Porcentaje en masa (m/m): Cantidad de gramos de soluto disuelto en 100 gramos de solución.
Porcentaje en volumen (V/V): Volumen en mililitros de soluto disuelto en 100 mililitros de solución.
Porcentaje masa a volumen (m/V): Cantidad de gramos de soluto disuelto en 100 mililitros de solución.
Partes por millón (ppm): Cantidad de miligramos de soluto disuelto en 1 litro (ó 1 Kg) de solución.
Formalidad (F): Cantidad de "moles fórmula" de soluto disuelto en 1 litro de solución. Un mol fórmula toma en cuenta la molécula de soluto sin disociar.
Molaridad (M): Cantidad de moles de soluto disuelto en 1 litro de solución.
Este concepto de mol se aplica a la molécula de soluto disociada en iones.
Molalidad (m): Cantidad de moles de soluto disuelto en 1 Kg de solvente.
Normalidad (N): Cantidad de equivalentes-gramo de soluto disuelto en 1 litro de solución. Equivalente-gramo es la cantidad de sustancia que reaccionaría con 1,008 gramos de hidrógeno, es decir, con un átomo-gramo de este elemento.
Fracción molar (X): Cantidad de moles de soluto o de solvente con respecto al número total de moles de la solución.
Porcentaje molar (X%); Fracción molar multiplicada por 100.
Ejercicios
REALICEMOS LOS SIGUIENTES EJERCICIOS:
- 1. Juan Rojas es empleado de la empresa ICEIM, de la ciudad de Bogotá, esta empresa es contratista del IDU, en una de las obras de la primera fase de transmilenio en la perforación de las calles; por el uso indebido del tapabocas tubo una fuerte gripa y el médico le formulo la aplicación de 1.5 de Dipirona C13H16N3O5NA en 180ml de suero para la aplicación intravenosa. Cuál será la Molaridad de esta solución?
- 2. Un operario de maquinaria pesada sufrió un intenso dolor de cabeza haciendo que detuviera su trabajo, el supervisor de salud ocupacional le suministro disolviendo 2,4 moles de Aspirina C7H6O3 en 10 ml de agua. Calcular cual es normalidad
- 3. Carlos Espinosa ha sufrido una alergia debido al trabajo que estaba realizando en una obra de la compañía Medios Asociados S.A. para el malestar ha tomado acetaminofen C8H9NO2 en 100 ml de agua cual será la Normalidad de esta solución?
- 4. Se agregan 8 gr. de amoxicilina C16H19N3O5Sen 5ml de agua para controlar la amigdalitis cual será la Molaridad?
Francisco Díaz, ha sufrido un desgarre en una pierna al bajar apresuradamente las escaleras de una construcción, para controlar el dolor le han formulado
2.5 gr. de naproxeno C14H14O3 en 120 gr. de agua. Cuál será la molalidad de esta solución?
- 5. El supervisor de una estación petrolera con un peso de 50kg subió las escaleras de un contenedor para verificar la presión, se resbalo produciéndose una grave fractura en su pierna izquierda lo cual el médico le aplico para el dolor 7gr de diclofenaco C14H11Cl2NO2.V.
Evaluación
1. Realiza el siguiente mapa conceptual en el cuaderno:
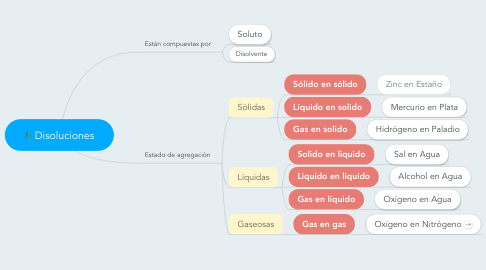
2. desarrolla los siguientes ejercicios:
- 1. Oscar Hernández trabaja como obrero en la compañía ONIVEC LTDA, tuvo un pequeño accidente y se ha fracturado un brazo, para dicho dolor se le ha formulado por un periodo de 8 días 4gr de Ibuprofeno C13H12O2 en 150ml de agua. Cuál será la Molaridad?
- 2. Cuál es la normalidad de una solución de peróxido de hidrogeno (dioxogen) en 2.0 moles con un volumen de 12ml el cual es utilizado por
un médico para desinfectar la herida de un obrero que se corto por el mal uso de una sierra?
- 3. Debido al ruido producido por las obras de la construcción donde está trabajando, Julián Rivera ha sufrido fuertes dolores de cabeza para esto ha tomado 3gr de aspirina C7H6O3 en 120 ml de agua. cuál será su normalidad?
- 4. El obrero de la empresa servicios y asociados sufrió un accidente cayendo de un segundo piso produciéndose una enorme herida en su mejilla el médico le receto 800gr de ibuprofeno C13H12O2 en 100ml de agua. cuál será la concentración molar?
Bibliografía
Foro
Cursos
| Curso | |
|---|---|
No results found. | |
Acceso a las actividades
| Actividad | Nombre | Fecha de ingreso | Fecha de actualización | Número de ingresos | Año | Curso | Subreporte |
|---|---|---|---|---|---|---|---|
No results found. | |||||||
