| Tema | estequiometria y soluciones |
|---|---|
| Evidencia | |
| calificable? | 0 |
| Activo | 1 |
Propósito
GUÍA # 3:
Que el estudiante realice un repaso del tema de estequiometria desarrollando ejercicios prácticos sobre el tema.
Motivación
Recordemos el concepto de estequiometria:
Reacción química de formación de dióxido de carbono a nivel molecular :
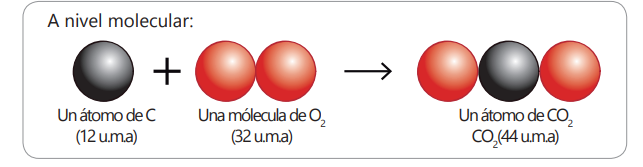
u.m.a: Unidad de Masa Atómica
Reacción química de formación de dióxido de carbono a nivel macroscópica:
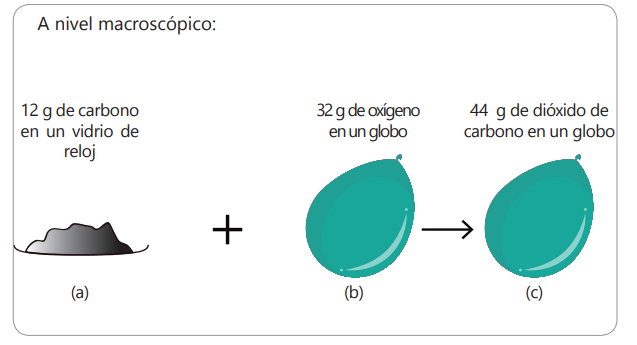
Analiza y escribe comentarios sobre lo que entiendes de las imágenes.
Explicación
Estudiemos el siguiente mapa conceptual:
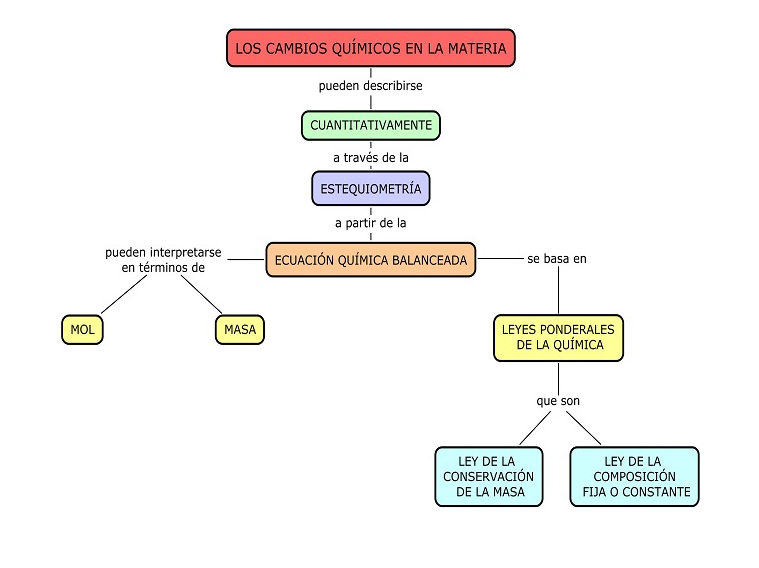
Ejercicios
Continuemos desarrollando ejercicios sobre estequiometria:
1.El amoniaco gaseoso puede preparase haciendo reaccionar un óxido metálico como el óxido de calcio con cloruro de amonio.

Si se mezclan 112g de CaO y 224g de NH4Cl
a. ¿Qué masa de NH3 se podrá producir?
c. ¿Qué masa de reactivo en exceso quedará después de la formación del amoniaco?
d. Cuántos gramos sobran del reactivo en exceso?
2. La mezcla de CO y H2 produce 407g de CH3OH
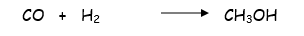
Si en realidad sólo se producen 332g de CH3OH, ¿Cuál es el rendimiento porcentual del compuesto?
3. Si se mezclan 112g de CaO y 224g de NH4Cl, el rendimiento teórico de NH3 es 68g. Si sólo se obtienen 16.3g de NH3 en realidad, ¿Cuál es el rendimiento porcentual?
4. El compuesto color azul oscuro Cu(NH3)4SO4 se fabrica haciendo reaccionar sulfato de cobre (II) con amoniaco.
CuSO4+4NH3Cu(NH3)4SO4
a. Si se emplean 10g de CuSO4 con 78% de pureza y un exceso de NH3,
¿Cuál es el

rendimiento teórico de Cu(NH3)4SO4?
b. Si se obtienen12.6gdeCu(NH3)4SO4,¿Cuál es el rendimiento porcentual?
5.Una muestra de 1.506g del material al 65% de pureza que contiene piedra caliza produce 0.558g de CO2, además de CaO, tras calentarse a alta temperatura. ¿Cuáles el porcentaje en masa de CaCO3 en la muestra original?
A altas temperaturas el NaHCO3 se transforma cuantitativamente en Na2CO3.
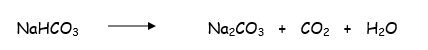
6. El cuerpo expulsa el exceso de nitrógeno en forma de urea, NH2CONH2. La reacción para la producción de la misma es la combinación de arginina (C6H14N4O2) con agua para dar urea y ortinina (C5H12N2O2).

Si una persona excreta 95mg de urea, ¿Qué masa de arginina debe haberse empleado? ¿Qué masa de ortinina debe haberse producido?
7. La sacarina, un endulzante artificial, tiene la fórmula C7H5N3S. Suponga que tiene una muestra de 0.2140g de endulzante, que contiene sacarina. Tras la descomposición para liberar el azufre y transformarlo en el ión SO42-, insoluble en agua. La cantidad obtenida de BaSO4 es 0.2070g. ¿Qué porcentaje en masa de sacarina contiene la muestra endulzante?
8..El plomo y el ácido sulfúrico reaccionan para producir sulfuro de plomo e hidrogeno, Determine la reacción:
¿Cuál es el rendimiento teórico del PbS al hacer reaccionar 0.4 gramos de H2S y 2.0 gramos de Pb?
9..El sulfuro de plomo se descompone en presencia del peroxido de hidrógeno, para producir sulfato de plomo y agua, según la reacción:
PbS + 4H2O2---------->PbSO4 + 4H2O
¿Cuál es el rendimiento teórico de PbSO4 a partir de 0.16 gramos de H2O2?
Evaluación
Realiza los siguientes ejercicios:
1. Al hacer reaccionar flúor con azufre se produce un gas incoloro que se llama hexafluoruro de azufre SF6. Si la reacción química es
S8+ 24 F2 -----> 8SF6, calcule:
- a)¿Cuántos gramos de SF6 se producen con 100 graos de azufre?
- b)Cuantos gramos de azufre reaccionarían totalmente con 240 gramos de Flúor?
- c)Cuantos moles de SF6 se producirán con 120 g de flúor?
- d)¿Cuántos moles de azufre reaccionarían con 10 moles de flúor
- 2. El C6H5Cl se puede preparar mediante la siguiente secuencia de reacciones:
3C + CaO----->CaC2 + CO
CaC2 + 2H2O-----> C2H2 + Ca(OH)2 3C2H2 ----->C6H6
C6H6 +Cl2 ----->C6H5Cl
Calcular los moles de de C6H5Cl que se pueden obtener con una tonelada de carbono de 80 % de pureza.
Respuesta: 7407,4 moles
- 3.El COCl2 reacciona con H2O para producir CO2 y HCl . Calcular la máxima cantidad de HCl que se puede obtener al hacer reaccionar 10 moles de COCl2 con 360 g de agua.
Respuesta: 730 g
- 4.Teniendo en cuenta la siguiente reacción: C3H8 + O2 > CO2 + H2O
- a)Cuantos gramos de CO2 del 60 % de pureza se podrán obtener al quemar 1,2 moles de C3H8 con 5,6 moles de O2 si la eficiencia de la reacción es del 80%?
- b)Si al reaccionar 28,8 gramos de C3H8 con exceso de O2 se obtienen 0,9 moles de CO2, Calcular el rendimiento de la reacción.
Respuesta: a) 197 g b)45%
- 5.Carbonato de calcio se descompone por la acción del calor originando óxido de calcio y dióxido de carbono.
- a)Formula la reacción que tiene lugar y ajústala.
- b)Calcula qué cantidad de óxido de calcio se obtiene si se descompone totalmente una tonelada de carbonato de calcio.
Respuesta: 560 kg CaO
- 6.En un alto horno, el mineral de hierro, Fe2O3, se convierte en hierro mediante la reacción:
Fe2O3 (s)+3 CO (g)----- >2 Fe (l) + 3 CO2 (g)
- a)¿Cuántos moles de monóxido de carbono se necesitan para producir 20 moles de hierro?
- b)¿Cuántos moles de CO2 se desprenden por cada 10 moles de hierro formado?
Respuesta: a) 30 moles COb) 15 moles CO2
- 7.¿Cuántas moléculas de O2 pueden obtenerse por la descomposición de 300 g de KClO3 de acuerdo a la siguiente ecuación no igualada?
KClO3---- >KCl + O2
Respuesta:2.21 x 1024
- 8.La soda cáustica, NaOH, se prepara comercialmente mediante la reacción de carbonato de sodio con cal apagada, Ca(OH)2. Determine la masa de soda cáustica que se puede obtener al hacer reaccionar 50.0 kg De carbonato de sodio de 95.8% de pureza con exceso de cal apagada.
Respuesta: 36.2 kg
- 9.El bromo se puede obtener en el laboratorio por reacción del bromuro de potasio, el ácido sulfúrico y oxido de manganeso (IV), de acuerdo con la ecuación: 2KBr + MnO2 + 3H 2SO4 ----- > 2HKSO4 + MnSO4 + Br2 + 2H2O
Calcular las cantidades de KBr, MnO2 con un 92,5 % de pureza, y H2SO4 al 60
% que se necesitan para obtener 60.0 g de Br2.
- 10.El H2SO4 se obtiene mediante la siguiente serie de reacciones: 4FeS2 +11 O2-----> 2 Fe2O3+8SO2
2SO2 +O2-----> 2SO3 SO3 +H2O -----> H2SO4
- a)¿Cuántos gramos de H2SO4 puro se pueden obtener por la reacción de 500 gramos de pirita de hierro (FeS2) pura?
- b)¿Cuántos gramos de H2SO4 puro se pueden obtener por la reacción de 250 gramos de pirita de hierro (FeS2) del 80% de pureza?
- c)Si la eficiencia de la reacción es del 75 % y se parte de 500g de pirita (FeS2) del 80 % de pureza, calcular los gramos de H2SO4 obtenidos si su pureza es del 90%.
- d)Calcular los moles de O2 necesarios para producir 8 moles de H2SO4 si la eficiencia de la reacción es del 75%.
Respuesta: a) 817g b) 326.7 g c) 544g d) 20 moles
- 11.Utilizando la reacción balanceada: 4FeS + 7O2 -----> 2Fe2O3 + 4SO2
Calcular: a) el número de moléculas SO2 formadas a partir de 80 moléculas de FeS; b) el número de moléculas de O2 necesarias para reaccionar con 40 moléculas de FeS.
Respuesta: (a) 80 moléculas de SO2 (b) 70 moléculas de O2.
- 12. El hidróxido de sodio reacciona con el CO2 del aire para producir Na2CO3 sólido y H2O liquida. 500 g de NaOH puro se dejaron al aire durante un tiempo, comprobándose por análisis posterior que el contenido de NaOH era solo del 95% en peso. Calcular: a) Los moles de CO2 que reaccionaron b) Los gramo0s de Na2CO3 que se formaron. C) Los moles de H2O que se produjeron.
Respuesta: a) 31,25 x10 -2 b) 33,12c) 31,25 x 10 -2
- 13.El polvo de hornear puede prepararse agregando CO2 a una solución acuosa de NaCl y NH3:
NaCl (ac) + NH3 (g) + CO2 (g) + H2O ? NaHCO3 (ac) + NH4Cl (ac)
Si se mezclan 25 g de cada uno de los reactivos con un exceso de agua, se obtienen 24 g de NaHCO3. ¿Cuál es el porcentaje de rendimiento? ¿Qué masa sobra de reactivos en exceso?
Respuesta: 67%
- 14.Una forma de eliminar el CO2 del aire de una nave espacial consiste en hacer reaccionar dicho gas con NaOH: produce en una nave espacial con tres tripulantes en una misión de 6 días?
Respuesta: 36.3 kg
- 15.Para producir 5.00 kg de cloro se hacen reaccionar HCl comercial (36% en peso) y pirolusita (85% de MnO2):
HCl (ac)+ MnO2 (ac) ? Cl2 (g) + MnCl2 (ac) + H2O
¿Qué peso de cada reactivo se requiere si el rendimiento de la reacción es del 95%?
Respuesta: 30 kg de HCl, 7.6 kg de pirolusita
- 16.Una gota de HCl concentrado (0.600 mmol) se extiende sobre una superficie de aluminio y reacciona completamente con el metal de acuerdo con la reacción:
Al (s) + HCl (ac) ? AlCl3 (s) + H2 (g)
¿Cuál es el área del agujero producido? (densidad del aluminio = 2.70 g/cm3, espesor de la hoja = 0.10 mm).
Respuesta: 0.20 cm2
- 17. Considerar la siguiente reacción:
MnO2 (s) + 4 HCl (ac) ? MnCl2 (ac) + Cl2 (g) + 2 H2O (l)
Al inicio se ponen a reaccionar 4.5 g de MnO2 con 4.0 g de HCl. ¿Cuántos gramos de Cl2 se obtienen? Calcular la cantidad de reactivo en exceso que queda sin reaccionar.
CO2(g) + NaOH(s) ? Na2CO3(s) + H2O
Se estima que en 24 horas, un astronauta exhala aproximadamente 1000 g de CO2. ¿Cuántos kilogramos de NaOH de un 90% de pureza se requieren para eliminar el CO2 que se produce en una nave espacial con tres tripulantes en una misión de 6 días?
Respuesta: 36.3 kg
- 18.Para producir 5.00 kg de cloro se hacen reaccionar HCl comercial (36% en peso) y pirolusita (85% de MnO2):
HCl (ac)+ MnO2 (ac) ? Cl2 (g) + MnCl2 (ac) + H2O
¿Qué peso de cada reactivo se requiere si el rendimiento de la reacción es del 95%?
Respuesta: 30 kg de HCl, 7.6 kg de pirolusita
Bibliografía
Foro
Cursos
| Curso | |
|---|---|
No results found. | |
Acceso a las actividades
| Actividad | Nombre | Fecha de ingreso | Fecha de actualización | Número de ingresos | Año | Curso | Subreporte |
|---|---|---|---|---|---|---|---|
No results found. | |||||||
