| Tema | Las reacciones químicas y las leyes que rigen las ecuaciones químicas |
|---|---|
| Evidencia | |
| calificable? | 1 |
| Activo | 1 |
Propósito
Aplica las normas de la nomenclatura stock, tradicional y sistemática para nombrar y formular compuestos inorgánicos e identifica cambios químicos en la vida cotidiana y los representa mediante una ecuación química.
Motivación
¿Por qué crees que se producen burbujas cuando se limpia una herida con agua oxigenada?

Explicación
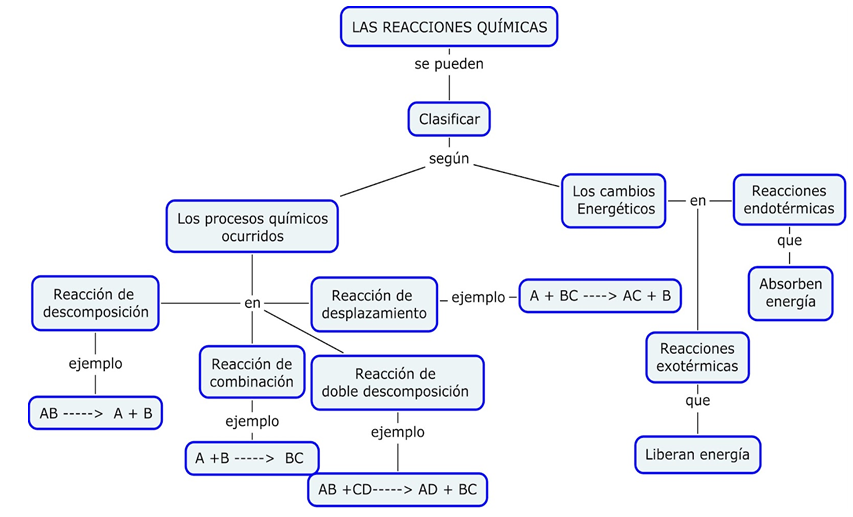
- ¿Qué es una reacción química?
Las reacciones químicas (también llamadas cambios químicos o fenómenos químicos) son procesos termodinámicos de transformación de la materia. En estas reacciones intervienen dos o más sustancias (reactivos o reactantes), que cambian significativamente en el proceso, y pueden consumir o liberar energía para generar dos o más sustancias llamadas productos.
Toda reacción química somete a la materia a una transformación química, alterando su estructura y composición molecular (a diferencia de los cambios físicos que sólo afectan su forma o estado de agregación). Los cambios químicos generalmente producen sustancias nuevas, distintas de las que teníamos al principio.
Muchos de los materiales que empleamos a diario son obtenidos industrialmente a partir de sustancias más simples combinadas mediante una o diversas reacciones químicas.
Fuente: https://concepto.de/reaccion-quimica/#ixzz708HPI0X3
Observa la presentación sobre las reacciones químicas para profundizar en el tema y aclarar dudas.
https://drive.google.com/file/d/16P1bNuYkBa3cg9qXtUd6hVR-evjz4ucu/view?usp=sharing
Utiliza el anterior mapa conceptual para responder:
Realiza el juego interactivo:
Tipos de reacciones químicas https://www.cerebriti.com/juegos-de-ciencias/tipos-de-reacciones-quimicas
La ley de la Conservación de la Materia, es también llamada ley de conservación de la masa o Ley de Lomonósov-Lavoisier, en honor a sus creadores.
Postula que la cantidad de materia antes y después de una transformación es siempre la misma. Es una de las leyes fundamentales en todas las ciencias naturales. Se resumen con la célebre frase: “nada se pierde, nada se crea, todo se transforma”.
-Balancear por el método de tanteo consiste en colocar números grandes denominados "Coeficientes" a la derecha del compuesto o elemento del que se trate. De manera que Tanteando, logremos una equivalencia o igualdad entre los reactivos y los productos.
Como todo lleva un orden a seguir, éste método resulta más fácil si ordenamos a los elementos de la siguiente manera:
Balancear primeroObserva la presentación sobre las reacciones químicas para profundizar en el tema y aclarar dudas.
https://drive.google.com/file/d/16P1bNuYkBa3cg9qXtUd6hVR-evjz4ucu/view?usp=sharing
Utiliza el anterior mapa conceptual para responder:
Realiza el juego interactivo:
Tipos de reacciones químicas https://www.cerebriti.com/juegos-de-ciencias/tipos-de-reacciones-quimicas
La ley de la Conservación de la Materia, es también llamada ley de conservación de la masa o Ley de Lomonósov-Lavoisier, en honor a sus creadores.
Postula que la cantidad de materia antes y después de una transformación es siempre la misma. Es una de las leyes fundamentales en todas las ciencias naturales. Se resumen con la célebre frase: “nada se pierde, nada se crea, todo se transforma”.
-Balancear por el método de tanteo consiste en colocar números grandes denominados "Coeficientes" a la derecha del compuesto o elemento del que se trate. De manera que Tanteando, logremos una equivalencia o igualdad entre los reactivos y los productos.
Como todo lleva un orden a seguir, éste método resulta más fácil si ordenamos a los elementos de la siguiente manera:
Balancear primero
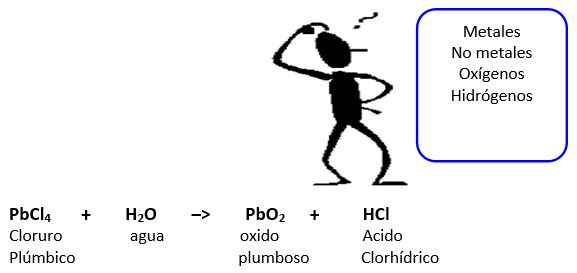
Paso 1. Enlistamos los elementos de tal manera que podamos ver si estos se encuentran equilibrados de ambos lados:
1 Pb 1
4 Cl 1
2 H 1
1 O 2
Paso 2. Debemos equilibrar el CL, H y O; para ello hacemos lo siguiente:

-Método del redox u oxido-reducción: El método del cambio de los números de la oxidación es relativamente sencillo, y es un modo fácil de equilibrar las ecuaciones redox. Se basa en el hecho de que el aumento de los números de la oxidación de los reactantes que han sido oxidados tiene que ser idéntico a la disminución de los números de oxidación de los reactantes que han sido reducidos.
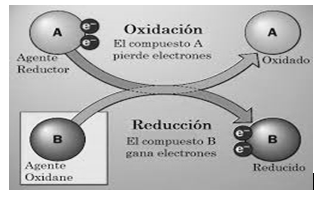
A continuación se describe el método y se ilustra simultáneamente con un ejemplo:
1. escribe correctamente la ecuación química que vas a balancea:
Fe2O3 + CO ? Fe + CO2
2. Determina y asigna los números de oxidación a cada uno de los átomos de las sustancias que actúan como reactantes y productos.
Fe+32+O-23 + C+2+O-2 ? Fe0 + C+4+O-22
3. Identifica cuáles átomos se han oxidado y cuáles se han reducido.
En esta ecuación, el Fe disminuye su número de oxidación de (+3 a 0), el cambio es de (-3e-). Esto significa que el hierro se redujo o sea ganó 3e-, al contrario, el carbono aumentó su número de oxidación de (+2 a +4), el cambio fue de (+2e-). El carbono se óxido. El oxígeno no cambia su número de oxidación.
4. Usa líneas de conexión entre los átomos que se han oxidado y los que se han reducido. Escribe el cambio en el número de oxidación en el punto medio de cada línea.
5. Multiplica el número de electrones por factores adecuados para que el número total de electrones ganados sea igual al número de electrones cedidos. En el ejemplo, el número de oxidación que disminuyó (Fe) se multiplica por 2 y el número de oxidación que aumentó (C) se multiplica por 3. De esta manera, el número de electrones cedido es -6 y el número de electrones ganados es +6 .Para balancear la ecuación, coloca el coeficiente 3 al Frente de la molécula de CO y CO2. Para nivelar el Fe simplemente, coloca 2 al frente de Fe. A la molécula de Fe2O3 no es necesario colocarle ningún coeficiente pues está indicando 2Fe.
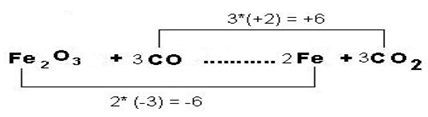
6. Finalmente, revisa la ecuación para que estés seguro que está bien balanceada. Si es necesario termina de balancear la ecuación por la simple inspección o tanteo.
Estequiometria
Permite el cálculo de las relaciones cuantitativas entre reactivos y productos en el transcurso de una reacción química. Es indispensable que la ecuación este balanceada.
Ejemplos de la estequiometria en la vida diaria
– Recetas de cocina
La mayoría de las personas adoran las galletas. En este caso, la estequiometria nos ayuda de la siguiente forma;
Si deseas hacer 10 galletas, la “ecuación” química de la masa de reactivos (productos químicos antes de la reacción) sería:
200 gramos de harina + 2 huevos + 200 gramos de mantequilla + 1 taza de azúcar = 10 galletas.
Pero, resulta que la masa de reactivo que tienes, o mejor dicho los ingredientes, están incompletos porque solo tienes un huevo. Se realiza una nueva ecuación química, donde se corta todo a la mitad para conseguir un resultado:
100 gramos de harina + 1 huevos + 100 gramos de mantequilla + 1/2 taza de azúcar = 5 galletas.
Las 5 galletas serían la masa de productos (productos químicos después de la reacción), o sea, el resultado de la unión de los ingredientes a través de una ecuación química.
No olvides la presentación que te permitirá profundizar en el temay aclarar las dudas al respecto
https://drive.google.com/file/d/16P1bNuYkBa3cg9qXtUd6hVR-evjz4ucu/view?usp=sharing
Realiza el juego interactivo:
Estequiometria https://www.cerebriti.com/juegos-de-ciencias/chemgame
Ejercicios
1.-Escribe V, si el enunciado es verdadero y F, si es falso:
A. La electrolisis es una reacción de descomposición.
B. Una reacción de desplazamiento es el proceso inverso de una reacción de síntesis.
C. Las reacciones exotérmicas liberan energía.
D. Las reacciones donde el oxígeno donde el oxígeno es un reactivo se denominan oxidaciones,
2.-Para poner en práctica el método de balanceo por oxidación-reducción, balancear la siguiente reacción química:

No olvide asignar nombres a cada sustancia, números de oxidación y determinar la sustancia oxidada, reducida, el agente oxidante y el agente reductor.
Evaluación
1.-Determina el tipo de reacción que se presenta en cada ecuación:
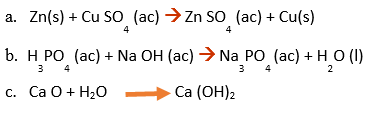
2.-Balancear las siguientes ecuaciones por el método del tanteo o inspección simple, no olvide colocar los números de oxidación y los nombres de cada sustancia.

3.-A partir de la siguiente ecuación balanceada, calcula:
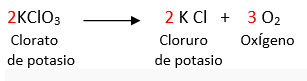
a. ¿Cuántas moles de oxígeno se producen a partir de 2 moles de clorato de potasio?
b. ¿Cuántos gramos pesan 2 moles de clorato de potasio?
c. ¿Cuántas moles de oxigeno se producen a partir de 4 moles de clorato de potasio?
d. ¿Cuántos gramos pesa 1 mol de oxígeno?
e. ¿Cuántos gramos pesan 3 moles de oxígeno?
4.-Observa y contesta:
Reactivo límite, actividad de laboratorio.
https://www.youtube.com/watch?v=g0yZ4lLs4J0
a. ¿Cuál es el gas que se produce?
b. ¿Cuál es el reactivo límite?
Bibliografía
Hola química. Editorial Susaeta
Investiguemos 10. Editorial Voluntad
Taller de Quimica 10. Editorial educativa
Contextos Naturales 10, Quimica. Editorial Santillana
Foro
Acceso a las actividades
| Actividad | Nombre | Fecha de ingreso | Fecha de actualización | Número de ingresos | Año | Curso | Subreporte |
|---|---|---|---|---|---|---|---|
| 9221 | CAICEDO HERRERA NICOLAS ANDRES | 2021-07-18 20:23:13 | 2021-07-18 20:23:13 | 1 | 2021 | Explicación |
