a) 
b) 
c) 
d) 
e) 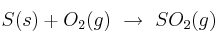
f) 
g) 
h) 
i) 
j) 
k) 
l) 
m) 
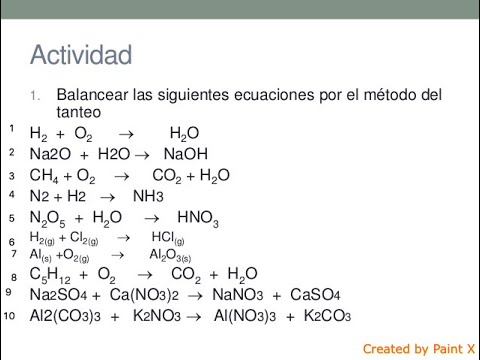
Balancear por tanteo
| Tema | Reacciones Químicas |
|---|---|
| Evidencia | |
| calificable? | 1 |
| Activo | 1 |
Que el estudiante conozca las reacciones químicas, las balancee utilizando los dos métodos (Tanteo, redox ) mediante la resolución de ejercicios de aplicación , para ampliar sus conocimientos frente a la diversidad de reacciones que se presentan e manera continua en su entorno.
Una reacción química, también llamada cambio químico o fenómeno químico, es todo proceso termodinámico en el cual dos o más especies químicas o sustancias, se transforman, cambiando su estructura molecular y sus enlaces, en otras sustancias llamadas productos. Los reactantes pueden ser elementos o compuestos
Las reacciones químicas se representan mediante ecuaciones en las que los reactivos o sustancias iniciales se colocan antes de la flecha y los productos o sustancias nuevas se ubican después de la flecha. Deben incluirse los estados de agregación de las sustancias, aunque si todas están en disolución o son gaseosas, se pueden obviar.
Reactantes.......?.....Productos
AB (g) + CD(g) ? AC(g) + BD(g)
Continuamente los átomos están tratando de alcanzar el estado más estable posible, es decir, el que requiera menos energía. Para lograrlo interactúan con otros átomos, intercambiando o compartiendo electrones mediante enlaces químicos. Por esta razón, en una reacción química los átomos no cambian. Solo cambian los tipos de enlaces químicos que los unen.
También debes tener en cuenta que para que ocurra una reacción química los reactivos deben chocar ya que la energía es necesaria para romper los enlaces químicos entre átomos.
A continuación te presentamos diferentes tipos de reacciones químicas y ejemplos que te ayudarán a comprenderlas fácilmente:
En estas reacciones químicas dos o más sustancias (reactivos) se combinan para formar otra sustancia (producto) más compleja. Un ejemplo cotidiano es el amoníaco, que se forma mediante una reacción de síntesis entre el nitrógeno y el hidrógeno. ejemplo: N2 + 3H2 ------------------ 2NH3
Al contrario que en las reacciones químicas de síntesis, en las de descomposición un compuesto químico se divide en sustancias más simples. Por ejemplo, mediante la electrólisis del agua (H2O), esta se separa en hidrógeno (H) y oxígeno (O).
H2O electrolisis H2 + O2
HCl+ Zn ------------ ZnCl2 + H2 en esta reacción se desplaza el hidrogeno por el Zn . el hidrogeno se desprende en forma de gas
AgCl+NaNO3 --------- AgNO3+ NaCl esta reacción es de desplazamiento doble, la plata se intercambia con el sodio para producir 2 compuestos diferentes a los iniciales : cloruro de sodio y nitrato de plata que forma un precipitado.
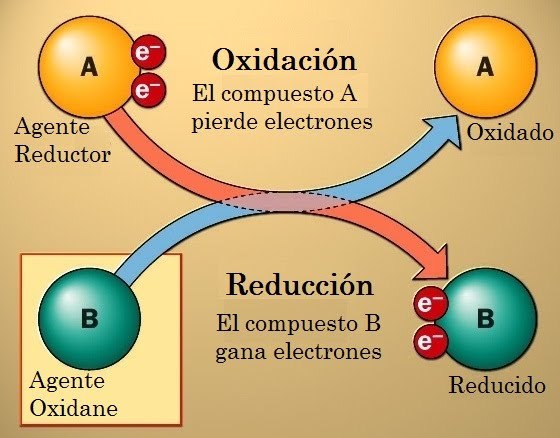
La principal característica de las reacciones redox es que hay un intercambio de electrones. Uno de los compuestos pierde electrones mientras que el otro los gana. Decimos que el compuesto que pierde electrones se oxida y el que los gana se reduce. De ahí proviene el nombre de las reacciones redox: REDucción-OXidación.
Puede sonarte extraño pero este tipo de reacciones químicas ocurren continuamente en la naturaleza. De hecho, no tenemos que ir muy lejos para buscar ejemplos de reacciones redox. Ahora mismo, respirando, estás llevando a cabo una. A partir del oxígeno del aire generamos moléculas de dióxido de carbono y agua.
También gracias a las reacciones redox las plantas hacen la fotosíntesis, ya que esta implica que el dióxido de carbono se reduzca en azúcares y que el agua se oxide, formando oxígeno. Otro ejemplo muy visual es cuando el metal reacciona con el oxígeno, formando óxidos.
En realidad la combustión es un tipo de reacción redox. La diferenciamos porque en el caso de las reacciones de combustión la oxidación se realiza de forma extremadamente rápida y potente. Para que ocurra, un material combustible se combina con el oxígeno y se desprende energía, normalmente calorífica y lumínica. Como producto, se genera dióxido de carbono y agua.
Puedes ver claros ejemplos de la reacción de combustión cuando te calientas delante de la chimenea. La leña arde y se combina con el oxígeno para formar dióxido de carbono y vapor de agua, al mismo tiempo que genera gran cantidad de energía química en forma de calor y luz.
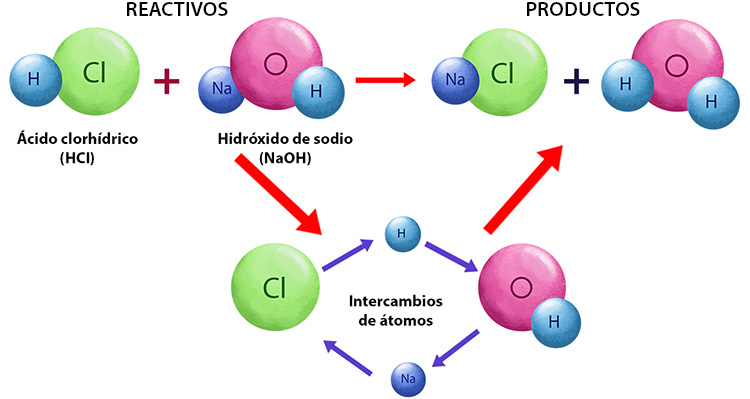
Este tipo de reacción química una sustancia básica y otra ácida se neutralizan entre ellas. Como resultado, se forma un compuesto neutro y agua. Como ejemplo, cuando el ácido clorhídrico reacciona con el hidróxido de sodio se produce sal (cloruro de sodio) y agua.
A diferencia de las anteriores, en las reacciones nucleares no se modifican los electrones de los átomos, sino su núcleo. Hay dos tipos de reacciones químicas nucleares: la fusión, en la que se combinan diferentes átomos; y la fisión, en la que el núcleo de los átomos se fragmenta.
Por ejemplo, las reacciones nucleares se utilizan para obtener energía. Es lo que ocurre con el uranio, cuando es bombardeado con neutrones con tal de romper su núcleo.
Por otro lado, como ya hemos comentado, en las reacciones químicas siempre interviene la energía, que puede ser emitida o absorbida.
Llamamos reacciones exotérmicas las que provocan la emisión de energía, que normalmente se produce al menos en forma de calor. Aunque, por ejemplo, en el caso de las explosiones también se emite energía cinética.
En cambio, cuando se absorbe energía se está produciendo una reacción endotérmica. Como resultado, el producto final es más enérgico que los reactivos.
Como ya te habrás dado cuenta, estamos rodeados de reacciones químicas. Por supuesto, estas tienen lugar en los laboratorios pero también fuera de ellos. En las fábricas, en la atmósfera, en nuestras cocinas e incluso en el interior de nuestro cuerpo están constantemente llevándose a cabo reacciones químicas de todo tipo.

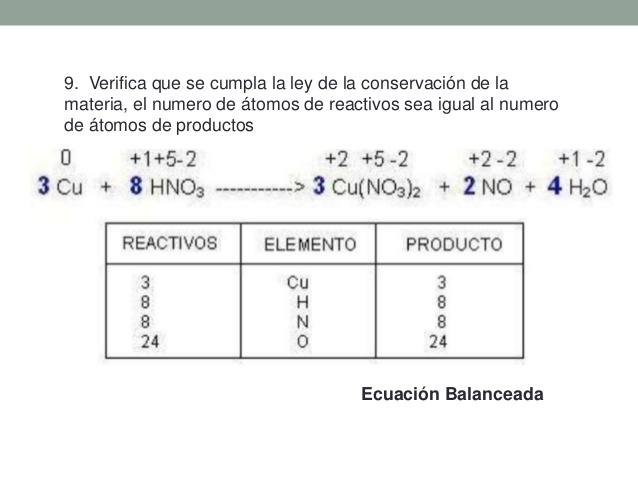
Lavoisier demostró que al efectuarse una reacción química la masa no se crea ni se destruye, sólo se transforma, es decir, las sustancias reaccionantes al interactuar entre sí forman nuevos productos con propiedades físicas y químicas diferentes a las de los reactivos, esto debido a que los átomos de las sustancias se ordenan de forma distinta.
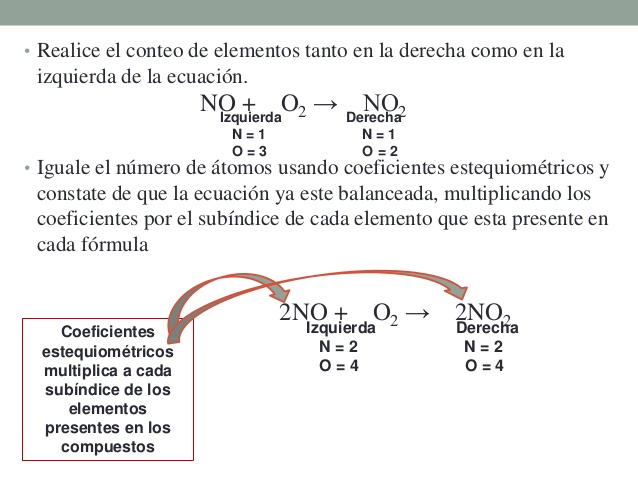
con base en lo anterior en las ecuaciones químicas se hace necesario realizar un proceso denominado ajuste. Consiste en colocar unos coeficientes estequiométricos delante de cada fórmula de modo que indiquen las veces que ésta se repite. Esos coeficientes afectan a toda la molécula, multiplicando a todos los elementos de la fórmula. Con estos números lograremos igualar el número de átomos de cada elemento en productos y reactivos. Dichos números deben ser enteros ya que no podemos hablar de una fracción de molécula. Es importante que identifiquemos la información que nos provee una formula quimica, que identifiquemos quienes son los coeficientes y quienes son los subíndices y a que elementos afecta

Para el ajuste podemos utilizar dos procedimientos:
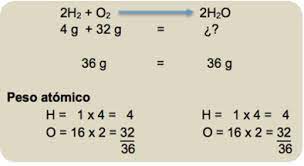
1. Por tanteo: Vamos probando hasta encontrar los coeficientes que nos sirvan. Suele facilitar las cosas dejar para el final los átomos que aparecen en más de una sustancia en alguno de los miembros de la ecuación.

ejemplo

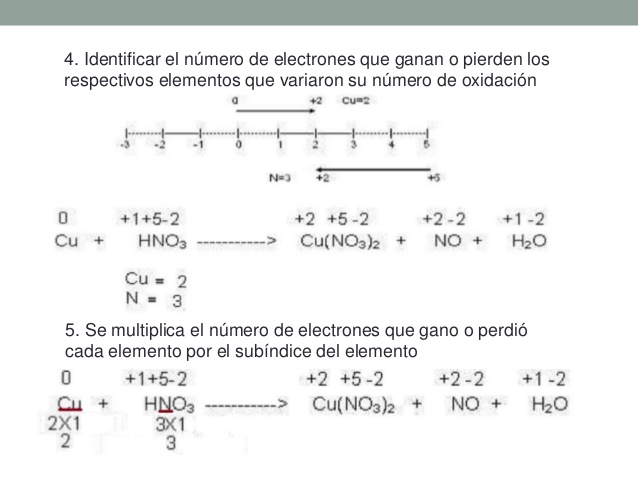
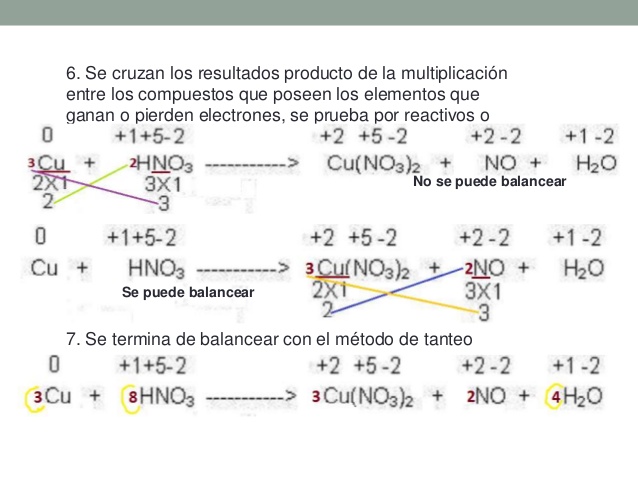
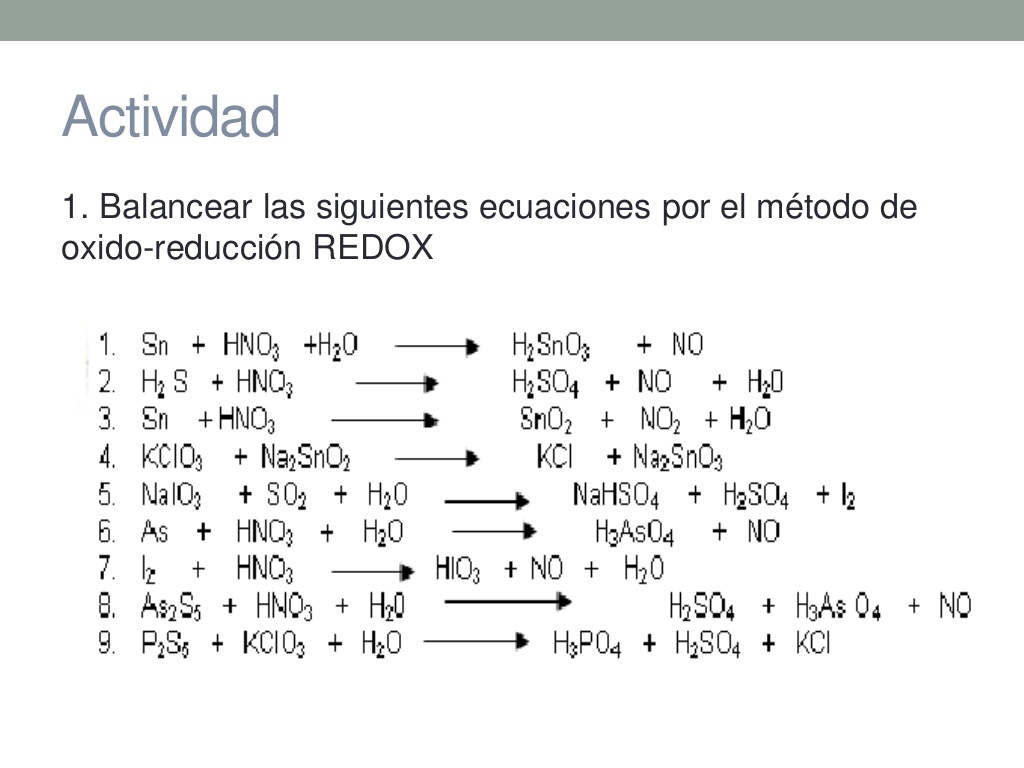
Balanceo por Redox: El método del cambio de los números de la oxidación es relativamente sencillo, y es un modo fácil de equilibrar las ecuaciones redox. Se basa en el hecho de que el aumento de los números de la oxidación de los reactantes que han sido oxidados tiene que ser idéntico a la disminución de los números de oxidación de los reactantes que han sido reducidos.
En este tipo de balanceo surgen los siguientes conceptos:
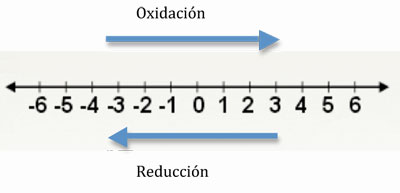
Oxidar: sinónimo de pérdida de electrones. se identifica porque el estado de oxidación aumenta. ejemplo
Ca0 -------------Ca+2el calcio pasa de un estado de oxidación cero a +2, es decir, aumenta el estado de oxidación lo que indica que el calcio se oxida, es decir pierde 2 electrones.
O-2 -----------O0 .El oxígeno tiene un estado de oxidación inicial de -2 y después de la reacción quedó como cero, esto me indica que aumenta en su estado de oxidación, por lo tanto el elemento se oxida. el oxigeno pierde 2 electrones.
Reducir: es sinónimo de ganancia de electrones. se identifica porque el estado de oxidación disminuye. el elemento se reduce. ejemplo:
O0 -----------O-2 .El oxígeno tiene un estado de oxidación inicial de 0 y después de la reacción quedó como -2, esto me indica que disminuye en su estado de oxidación, por lo tanto el elemento se reduce.
S+6 ------------S+2 .El azufre tiene un estado de oxidación inicial de +6 y después de la reacción quedó como +4, esto me indica que disminuye en su estado de oxidación, por lo tanto el elemento se reduce.
tenga en cuenta el desplazamiento en la siguiente recta numérica
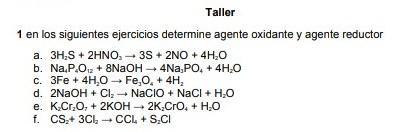
Agente Reductor: es la sustancia que contiene al elemento que se oxida ( el que pierde electrones)
Agente Oxidante: es la sustancia que contiene al elemento que se reduce(el que gana electrones)
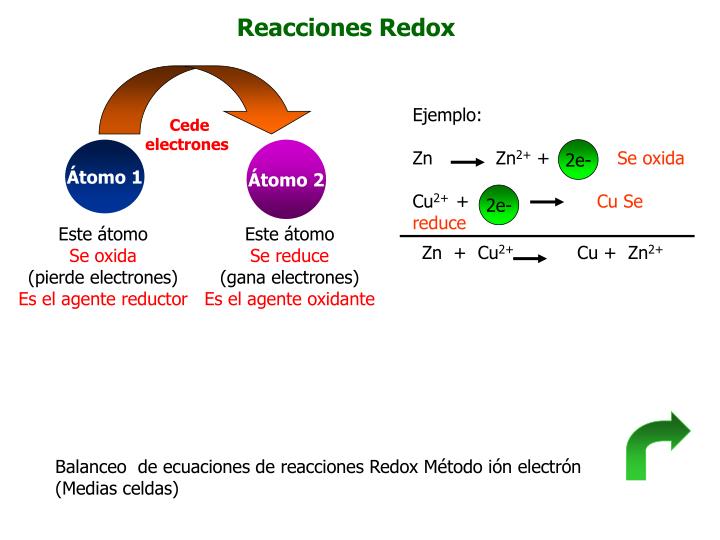

El proceso de balanceo por redox es el siguiente

1.
Clasifica las siguientes reacciones químicas en los tipos de reacciones diferentes que conoces:
a) 
b) 
c) 
d) 
e) 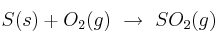
f) 
g) 
h) 
i) 
j) 
k) 
l) 
m) 
Balancear por tanteo

https://www.periodni.com/es/balanceo_de_ecuaciones_redox
https://ejercicios-fyq.com/Clasificacion-de-reacci...
https://www.zschimmer-schwarz.es/noticias/que-es-u...
https://www.aev.dfie.ipn.mx/Materia_quimica/temas/tema1/subtema4/subtema4.html
https://proyectodescartes.org/uudd/materiales_didacticos/Reacciones_quimicas-JS/reaccionesaula.pdf
https://www.slideshare.net/stepaca08/balanceo-metodo-redox-tema-4
| Actividad | Nombre | Fecha de ingreso | Fecha de actualización | Número de ingresos | Año | Curso | Subreporte |
|---|---|---|---|---|---|---|---|
No results found. | |||||||