| Tema | Funciones Quimicas II |
|---|---|
| Evidencia | |
| calificable? | 0 |
| Activo | 0 |
Propósito
Aplica las reglas de nomenclatura a las funciones químicas
Motivación
La vida es una reacción química que solo requiere de equilibrio.-Priyavrat Gupta.
Explicación
GUIA 01 FUNCIONES
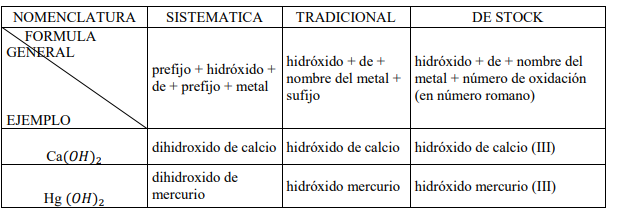
Función hidróxido o base
Las bases se forman por la reacción de un oxido metálico y agua. Se nombran de forma similar a los óxidos pero cambiando la palabra oxido por hidróxido. Observa algunos ejemplos de nomenclatura de hidróxido.
Función peróxido
Los peróxidos son sustancias que presentan un enlace oxigeno-oxigeno unido a otro elemento y se diferencian de los óxidos porque el oxígeno trabaja con número de oxidación -1. Generalmente se nombra mediante la nomenclatura tradicional como peróxidos, seguidos del nombre que acompaña al oxígeno. Peróxido + de + nombre del elemento que acompaña al oxigeno.
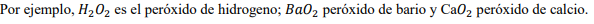
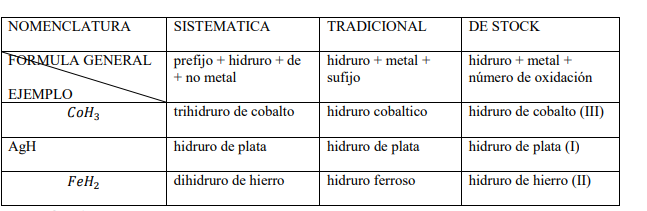
LOS HIDRUROS
Son combinaciones binarias de hidrogeno y otro elemento que puede ser metal o un no metal. Se clasifican en tres grupos.
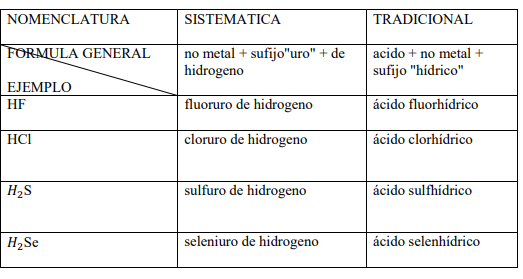
Hidruros no metálicos de los elementos de los grupos 16 y 17
Son combinaciones del hidrogeno (con número de oxidación +1) con los elementos F, Cl, Br y I con su menor número de oxidación (-1) y S, Se y Te con (-2). Tienen la particularidad de que sus disoluciones acuosas tienen carácter ácido y forman el grupo de los ácidos hidrácidos. Las nomenclaturas que se utilizan son la sistemática y la tradicional.
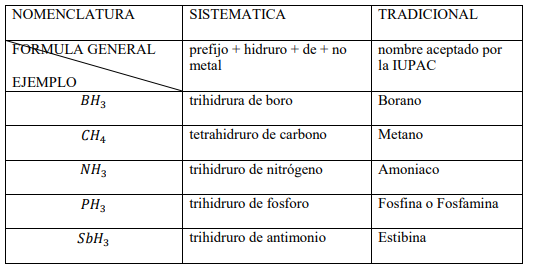
Hidruros no metálicos de los elementos de los grupos 13, 14 y 15
Son combinaciones del hidrogeno (con número de oxidación +1) con los elementos B, C, Si, N, P, As y Sb. Sus disoluciones no presentan carácter ácido y casi todos son muy volátiles. Tienen nombres tradicionales aceptados por la IUPAC. Observa algunos ejemplos.
Hidruros metálicos
Son combinaciones del hidrogeno con los metales. Se nombran de forma similar a los óxidos metálicos cambiando el nombre de la función por hidruro. Observa ejemplos.
Oxácidos
Oxácidos = óxido ácido + agua
Son compuestos ternarios, es decir contienen hidrogeno, oxígeno y un no metal en su estructura. Estos compuestos responden a una formula general del tipo Ha Xb Oc, donde X es normalmente un elemento no metálico, aunque también puede ser un elemento de transición como el cromo o el manganeso (los cuales a pesar de ser metales, también forman óxidos ácidos); a, b y c representan el número de átomos que hay de cada elemento en la molécula, son números enteros (1, 2, 3,4, etc.); el 1 por lo general se omite. En la formula se coloca en primer lugar el hidrógeno, luego el no metal y por último el oxígeno y si se puede se simplifica. Se nombran con la palabra genérica ácido seguida del nombre del no metal con la terminación oso para los compuesto de menor grado de oxidación, en el no metal e ico para los de mayor grado de oxidación en el no metal (hipo, oso, per – ico si es el caso)

Ejercicios
1. fórmula de los compuestos y otros nombre posible
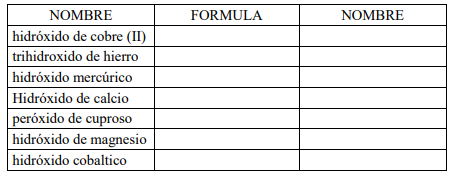
- Hidróxido de Litio
- Hidróxido de niquélico
- Hidróxido de plomo (IV)
- Hidróxido mercurioso
- Hidróxido auroso
- Hidróxido de cobre (I)
3. Nombrar cada una de las siguientes bases aplicando la nomenclatura stock y la común

4. Nombrar cada una de las siguientes bases aplicando la nomenclatura sistemática y la nomenclatura stock.

Evaluación
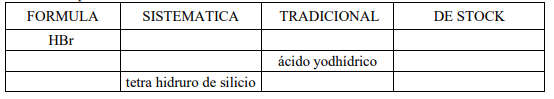
1. Completa la tabla
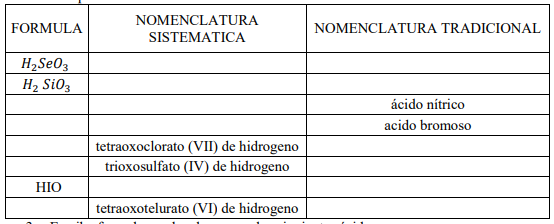
2. Completa la tabla
3.Escriba formulas moleculares para los siguientes ácidos
- Ácido sulfúrico
- Ácido selenioso
- Ácido fosfórico
- Ácido brómico
- Ácido arsenioso
- Ácido perclórico
Bibliografía
Foro
Cursos
| Curso | |
|---|---|
No results found. | |
Acceso a las actividades
| Actividad | Nombre | Fecha de ingreso | Fecha de actualización | Número de ingresos | Año | Curso | Subreporte |
|---|---|---|---|---|---|---|---|
No results found. | |||||||
