| Tema | Funciones Quimicas I |
|---|---|
| Evidencia | |
| calificable? | 0 |
| Activo | 0 |
Propósito
Aplica las reglas de nomenclatura a las funciones químicas
Motivación
Aprende del pasado, vive el presente y trabaja para el futuro.”
Explicación
GUIA 02 LOS NOMBRES QUIMICOS
Muchas de las sustancias químicas fueron descubiertas por el hombre desde épocas remotas y éste les fue asignado nombres que obedecían a diversas circunstancias, tales como el lugar de origen, el color y su utilidad, entre otras. Estos nombres fueron y son conocidos aún hoy como nombres vulgares, en el sentido de que son usados por el pueblo o vulgo. Así al acido que proviene de las frutas cítricas se le llamó ácido cítrico; de igual manera el nombre de agua para el compuesto H2O, es un nombre vulgar o común, y es el único que se emplea para denotar esta sustancia. A nadie se le ocurriría llamarla óxido de di hidrógeno, que es un nombre químico.
Asignarle nombre vulgares a los millones de compuestos conocidos seria en la actualidad un verdadero caos. Por este motivo se hizo necesario desarrollar un lenguaje especializado para referirse a los elementos y compuestos químicos de tal modo que sus nombres tuvieran alguna relación con la constitución del compuesto, para facilitar su estudio y memorización. Fue así como se creó un sistema de normas, comunes en todo el mundo, que se utiliza para denominar a los elementos y a los compuestos químicos. La entidad que regula y controla la designación y el uso de los nombres químicos recibe el nombre de Unión Internacional de Química Pura y Aplicada. IUPAC. Fue fundada en 1921 y está dirigida por un grupo de químicos de diversas partes del mundo, cuya exclusiva preocupación es estudiar los problemas corrientes de la nomenclatura química. En consecuencia de lo anterior podemos afirmar que las reglas de que nos valemos para nombrar cada sustancia, y de manera especial, cada compuesto, recibe el nombre de nomenclatura química.
COMPUESTOS QUIMICOS
La unión de elementos de distinta clase da origen a los compuestos químicos, estos se dividen en orgánicos e inorgánicos. Los compuestos inorgánicos están formados por elementos diferentes al átomo de carbono (con excepción de unos pocos compuestos que contienen este átomo). En este grupo están los óxidos, los hidruros, los peróxidos, las bases o hidróxidos, los ácidos y las sales.
Los compuesto orgánicos, contienen átomos de carbono en su estructura molecular y forman parte de los seres vivos o provienen de estos, pero también se sintetizan en el laboratorio. Son ejemplos de este grupo de compuestos los carbohidratos, los alcoholes, los ácidos nucleicos (ADN y ARN) y los lípidos.
FUNCIONES QUIMICAS INORGÁNICAS
Se llama función química a un conjunto de propiedades comunes que caracterizan a las sustancias, permitiendo diferenciarlas de las demás. Estas sustancias presentan un comportamiento propio. Las sustancias pertenecientes a una función química poseen en sus moléculas un átomo o grupos de átomos de estructura análoga que los caracterizan, a estos se les llama grupo funcional Por ejemplo, la función ácido se identifica porque en su estructura está el grupo funcional H+ (Hidronio). Cada función tiene sus propias características y comportamiento químico
Las funciones inorgánicas más importantes son: óxido, ácido, hidróxido o base y sal
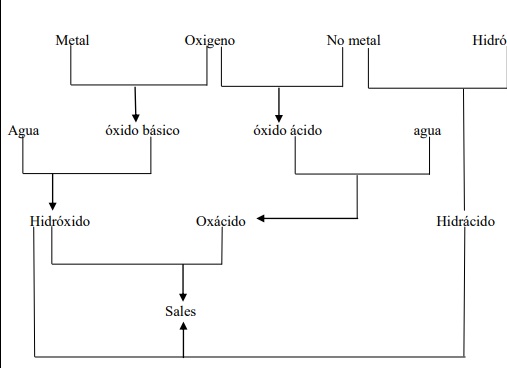
Los nombres de los compuestos
Cada día se conoce o sintetiza nuevos compuestos que se suman a la larga lista de los existentes, más de trece millones. Esto hace que resulte muy difícil utilizar nombres comunes, como polvo de hornear y leche de magnesia, sin que se llegue a confusiones. La IUPAC (unión internacional de química pura y aplicada) es una organización con sede en Basilea (suiza) que se encarga de establecer las normas que regulan la forma de nombrar (nomenclatura) y formular (formulación) los compuestos químicos. Gracias a la nomenclatura química se puede diferenciar un compuesto de otro: con esto se logran niveles de seguridad en la manipulación de sustancias, se facilita su comercialización y permite el avance científico de la química.
Valencia y números de oxidación
Las distintas posibilidades de combinación de un elemento están determinadas por dos conceptos: valencia y número de oxidación. La valencia, es el número de electrones perdidos [valencia iónica +], ganados [valencia iónica -] o compartidos [valencia covalente] por un átomo al combinarse con otro para formar un compuesto. Este término no deja de ser arbitrario ya que unas veces incluye signo y otras no, de ahí que la IUPAC recomiende sustituirlo por el otro concepto, de carácter general, aunque también definido por convenio. El número de oxidación de un átomo en un compuesto es un número teórico que indica el número de electrones que el átomo habría perdido o ganado si se considera que el compuesto se ha formado mediante enlaces iónicos. El número de oxidación, por tanto, siempre tiene signo. En general se puede establecer unas reglas y siempre se cumple que:


Ejercicios
Contesta las siguientes preguntas de acuerdo a la lectura los nombres quimicos
1. ¿Cómo se llama el sistema de normas que se utiliza para nombrar a los elementos y a los compuestos químicos?
2. ¿Qué es la IUPAC?
3. ¿Quién dirige la IUPAC?
4. ¿Qué preocupación tienen quienes dirigen la IUPAC?
Evaluación
1. ¿Cómo se clasifican los compuestos químicos?
2.¿Aproximadamente cuantos compuestos existen?
3. ¿Significado de la IUPAC?
4.¿Qué importancia tiene la nomenclatura química?
5. Escribe las reglas de formar compuestos.
Bibliografía
Foro
Cursos
| Curso | |
|---|---|
No results found. | |
Acceso a las actividades
| Actividad | Nombre | Fecha de ingreso | Fecha de actualización | Número de ingresos | Año | Curso | Subreporte |
|---|---|---|---|---|---|---|---|
No results found. | |||||||
