| Tema | La Tabla Periodica II |
|---|---|
| Evidencia | |
| calificable? | 0 |
| Activo | 0 |
Propósito
Reforzar procesos de lectoescritura que le permitan a los estudiantes buscar, seleccionar y organizar información utilizando diversas herramientas con el fin de favorecer la comprensión de conceptos en el área de ciencias naturales.
Motivación
- Utilizar adecuadamente la información que nos suministra la tabla periódica para comprender la estructura y el comportamiento de las sustancias.
Explicación
GUIA 3 TABALA PERIODICA II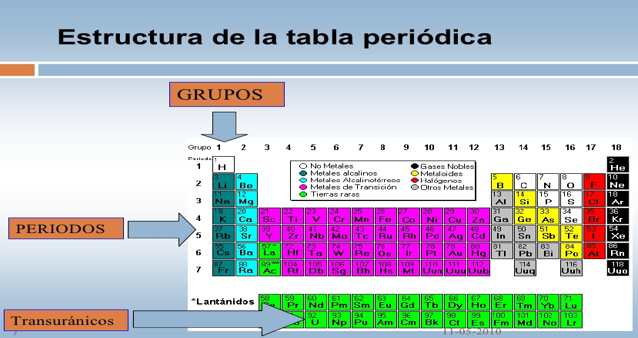
La tabla periódica también denominado Sistema Periódico, es un esquema de todos los elementos químicos dispuestos por orden de número atómico creciente y en una forma que refleja la estructura de los elementos. Los elementos están ordenados en 7 hileras horizontales, llamadas períodos, y en 18 columnas verticales, llamadas grupos.
Los grupos o columnas verticales de la tabla periódica fueron clasificados tradicionalmente de izquierda a derecha utilizando números romanos seguidos de las letras “A” o “B”, en donde la “B” se refiere a los elementos de transición. En la actualidad ha ganado popularidad otro sistema de clasificación, que ha sido adoptado por la Unión Internacional de Química Pura y Aplicada (IUPAC, siglas en inglés). Este nuevo sistema enumera los grupos consecutivamente del 1 al 18 a través de la tabla periódica.
LEY PERIÓDICA
Esta ley es la base de la tabla periódica y establece que las propiedades físicas y químicas de los elementos tienden a repetirse de forma sistemática conforme aumenta el número atómico. Todos los elementos de un grupo presentan una gran semejanza y, por lo general, difieren de los elementos de los demás grupos.
Clasificación Periódica
El procedimiento para clasificar los elementos colocándolos por orden de su número atómico y el comportamiento químico de los elementos llevó a dividirla en:
- 7 renglones horizontales llamados “períodos”, que corresponden a cada una de las 7 capas o nivelesde energía: K, L, M, N, O, P, Q. Los elementos que se encuentran en un mismo periodo tienen el mismo número de niveles de energía. Por ejemplo, todos los elementos que se encuentran el periodo 3 sus átomos poseen 3 niveles de energía.
- El número de columnas verticales se denomina “grupos”: I, II, III, IV, IV, VI, VII y VIII, y para que los elementos de propiedades semejantes se encuentren unos debajo de otros, cada uno de los grupos ha sido dividido en 2 subgrupos, a los que se les designa con la letra A y B. Por último, está el “grupo O” o gases nobles, que tienen como común denominador, la última capa orbital llena.
La importancia de la tabla periódica radica en determinar: número atómico, masa atómica, símbolo, actividad Química, características del elemento por su grupo y período, tipo o forma del elemento (gas,líquido, sólido, metal o no metal).
PERÍODOS: van de izquierda a derecha y determinan el número de niveles de energía de los átomos.
- 1er período: se capa característica es la K y tiene únicamente 2 elementos (H y He).
- 2do período: comprende en la estructura de sus átomos hasta la capa L, se le llama período corto por tener únicamente 8 elementos.
- 3er período: su última capa es la M; también es un período corto de 8 elementos.
- 4to período: su capa característica es la N, y contiene 18 elementos.
- 5to período: su capa característica es la O, contiene 18 elementos.
- 6to período: su capa característica es la P, contiene 32 elementos.
- 7mo período: su capa característica es la Q, contiene 19 elementos. Es la última capa orbital posible de un elemento.
GRUPOS O FAMILIAS: van de arriba hacia abajo y en algunos casos determinan los electrones del último nivel de energía de los átomos.
Grupo IA: son los metales alcalinos: litio, sodio, potasio, rubidio y cesio. Su número de valencia es +1.
Grupo IIA: son los metales alcalinos-térreos: berilio, magnesio, calcio, estroncio, bario y radio. Su número de valencia es +2.
Grupo IIIA: son los metales térreos: boro y aluminio. Su número de valencia es +3.
Grupo IVA: familia del carbono; los primeros son dos no metales (carbono y silicio), y los tres últimos son metales (germanio, estaño, y plomo). Sus valencias más comunes son +2 y +4. Grupo VA: familia del nitrógeno: nitrógeno y fósforo (no metales), arsénico, antimonio y bismuto (metales). Su número de valencia más común es +1, +3, +5,-1 y -3.
Grupo VIA: familia del oxígeno: oxígeno, azufre, selenio y teluro (no metales). Valencias -2, +2, +4 y +6.
Grupo VIIA: familia de los halógenos: flúor, cloro, bromo y yodo. Son no metales. Valencias -1, +1, +3, +5 y +7.
Grupo IB al VIIB: son los elementos de transición: todos ellos metales, entre los que destacan están:níquel, cobre, zinc, oro, plata, platino y mercurio. Su número de valencia varía según el elemento.
Grupo VIII: en cada período abarca 3 elementos: fierro, cobalto y níquel; rutenio, rodio y paladio;
osmio, iridio y platino. Sus números de valencia varían según el elemento.
Grupo VIIIA u O: son los gases nobles: helio, neón, argón, kriptón, xenón y radón. Su número de valencia es 0.
Ejercicios
1. Elabore un mapa mental sobre la organización de la tabla periódica. No olvide ser creativo, usar dibujos, símbolos, esquemas, colores, conceptos y relaciones acertadas. Revise el siguiente enlace para conocer cómo elaborar un mapa mental.
Evaluación
1. Establezca las diferencias entre los grupos y los periodos de la tabla periódica completando el siguiente cuadro comparativo.

Bibliografía
Foro
Cursos
| Curso | |
|---|---|
No results found. | |
Acceso a las actividades
| Actividad | Nombre | Fecha de ingreso | Fecha de actualización | Número de ingresos | Año | Curso | Subreporte |
|---|---|---|---|---|---|---|---|
No results found. | |||||||
