| Tema | El Modelo atómico actual |
|---|---|
| Evidencia | |
| calificable? | 1 |
| Activo | 1 |
Propósito
Establece relación entre la configuración electrónica del átomo, sus propiedades químicas y su ubicación en la tabla periódica a partir de los números cuánticos y utilizando representaciones para ello.
Motivación
- p§¿Qué tienen en común las galaxias y las rocas que componen nuestro planeta?
- §¿Qué dificultades crees que encuentran los científicos cuando estudian la composición de la materia?

Explicación
EXPLICACION 1
El modelo atómico es una representación estructural de un átomo que trata de explicar su comportamiento y propiedades.

Caracterizar los átomos
Se alrededor de un centenar de elementos distintos, que se identifican con un símbolo.
El símbolo de un elemento es el código universal, igual en todos los idiomas. Consiste en la inicial- o la inicial y otra letra-del nombre del elemento en latín.
Cada elemento esta formado íntegramente por átomos e un solo tipo. Pero ¿Qué distingue a los átomos de un elemento de los otros?
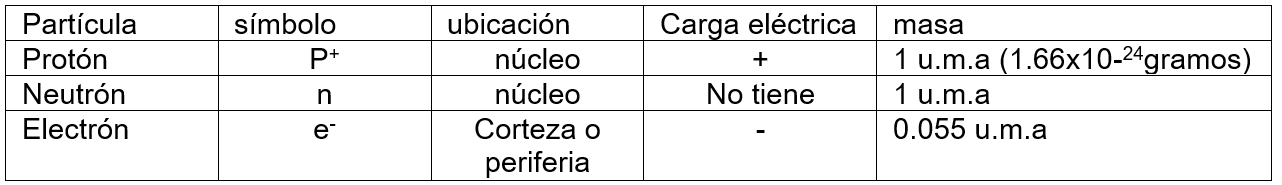
Los átomos de un elemento se distinguen por el número atómico (Z), el número de protones de su núcleo. Recordemos, en conjunto un átomo es eléctricamente neutro.
El Numero Masico o masa atómica (A), es La Suma de Protones y neutrones Contenidos en el núcleo, PUEDE Variar Entre los Átomos de la ONU Mismo Elemento A = Z + N
Isotopos
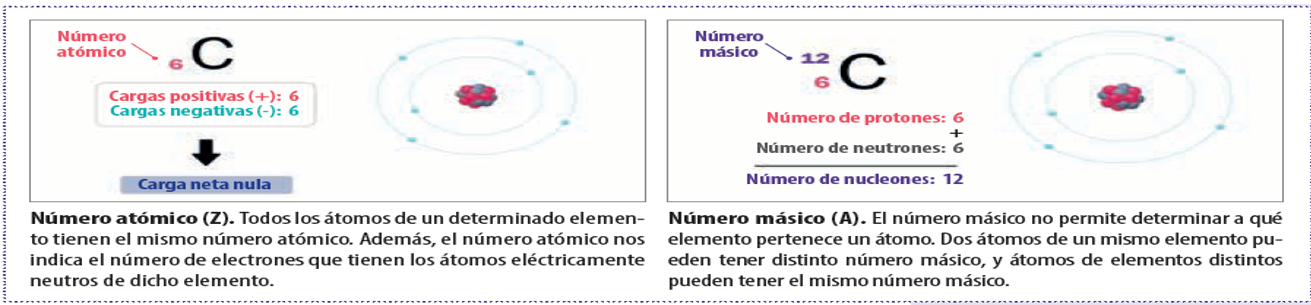
Son átomos de un mismo elemento que tienen un número diferente de neutrones.
En las primeras décadas del siglo XX, continuaba siendo un interrogante la forma como se organizaban los electrones alrededor del núcleo atómico. La respuesta a este interrogante provino de un campo al parecer sin relación con el átomo: la espectroscopia, rama de la ciencia que estudia la absorción y emisión de energía, en forma de luz por parte de la materia.
Las diferentes clases de espectros
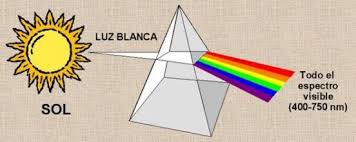
Cuando se descompone la luz blanca del sol con la ayuda de un prisma, se observa un abanico de colores. Se dice que la luz blanca posee un espectro continuo porque se pasa de un color al otro sin interrupción en la sucesión de colores. Experimentalmente, se constata que todo cuerpo (gaseoso o sólido) sometido a altas presiones y altas temperaturas, emite un espectro continuo de luz.
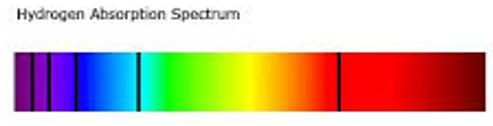
Espectro en absorción
Los átomos pueden no sólo emitir luz, sino que también pueden absorberla. Se puede constatar este fenómeno haciendo pasar una luz blanca a través un gas frío antes de dispersarla por un prisma. Cuando un gas a baja temperatura y baja presión es atravesado por una luz blanca, el espectro de luz transmitido está constituido por líneas negras sobre el fondo colorido del espectro de la luz blanca: es un espectro de líneas de absorción. La propiedad importante del espectro de líneas de absorción es que sus líneas aparecen en el mismo lugar que las líneas de emisión: el gas absorbe las radiaciones que sería capaz de emitir si fuese caliente.
Espectros de emisión
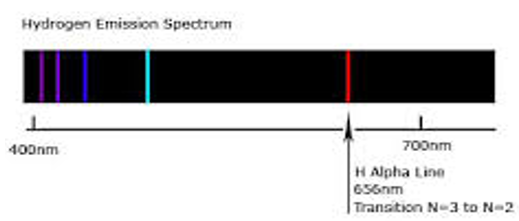
Si se analiza con un prisma la luz emitida por una lámpara de vapor de Sodio (un gas poco denso y caliente), se constatará que el espectro de la luz emitida está constituido por dos finas líneas poco intensas, en la parte amarilla del espectro, que destacan frente al negro de fondo. El espectro obtenido está constituido por un número limitado de radiaciones.
Un gas, a baja presión y alta temperatura, emite una luz constituida por un número limitado de radiaciones : Se obtiene un espectro de líneas de emisión. Los colores y posiciones de las líneas en el espectro son características de los átomos del gas que emiten esa radiación. O sea, cada elemento químico en el estado gaseoso posee su proprio espectro de líneas.
MODELO ATOMICO ACTUAL
La imposibilidad de dar una explicación teórica satisfactoria de los espectros de los átomos con más de un electrón con los principios de la mecánica clásica, condujo al desarrollo del modelo atómico actual que se basa en la mecánica cuántica.
También es conocido como el modelo atómico de orbitales, expuesto por las ideas de científicos como: E. Schrodinger y Heisenberg. Establece una serie de postulados, de los que cabe recalcar los siguientes:
- El electrón se comporta como una onda en su movimiento alrededor del núcleo
- No es posible predecir la trayectoria exacta del electrón alrededor del núcleo
- Existen varias clases de orbitales que se diferencian por su forma y orientación en el espacio; así decimos que hay orbitales: s, p, d, f.
- En cada nivel energético hay un número determinado de orbitales de cada clase.
- Un orbital atómico es la región del espacio donde existe una probabilidad aceptable de que se encuentre un electrón. En cada orbital no puede encontrarse más de dos electrones.
El modelo se fundamenta en los siguientes principios:
- Principio de onda-partícula de Broglie: Señala que la materia y la energía presentan caracteres de onda y partícula; que los electrones giran por la energía que llevan y describen ondas de una longitud determinada.
- Principio estacionario de Bohr: El mismo que señala que un electrón puede girar alrededor del núcleo en forma indefinida.
- Principio de incertidumbre de Heisenberg: Determina que es imposible conocer simultáneamente y con exactitud la posición y velocidad del electrón.
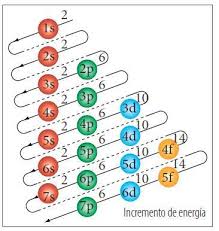
número cuántico principal, n, relacionado con la distancia promedio del electrón al núcleo del átomo y describe los niveles de energía en el que reside el orbital.
Los valores de n son enteros ? 1. (1,2,3,4,5,6,7,8)
número cuántico secundario, l, define dentro de cada nivel de energía si existen uno o varios subniveles que representan la forma de los diferentes orbitales por donde se mueven los electrones. Subniveles S, P, D. F
Utilizamos designaciones de letra para comunicar los distintos valores de l y, por lo tanto, las formas y tipos de orbitales
número cuántico magnético, m, (orbitales) describe la orientación tridimensional del orbital. Indica si dentro de un mismo subnivel de energía puede existir más de un orbital de la misma forma, con la misma energía, pero diferente orientación espacial.
El número cuántico spin: (ms) Determina el sentido en que gira el electrón sobre su propio eje. En un orbital máximo pueden girar 2 electrones.
Cuadro espectral

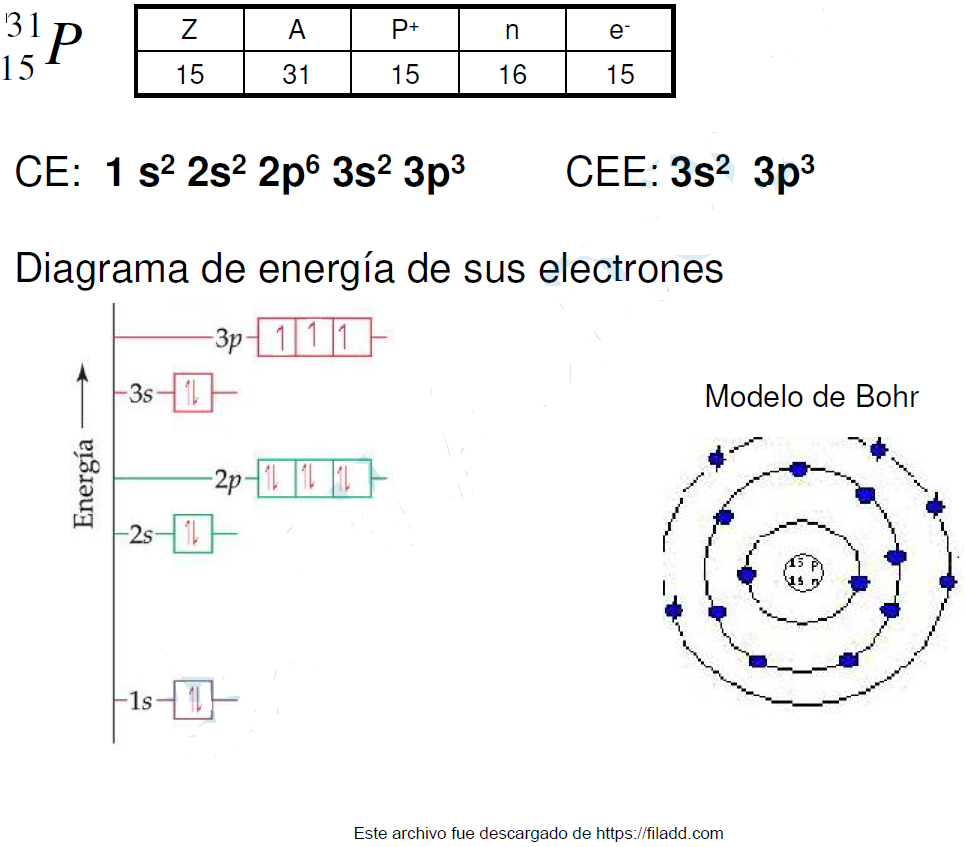
Principio de exclusión de Pauli: en un orbital no puede contener más de dos electrones, y los espines de dichos electrones deben tener valores opuestos y se representan mediante flechas.
Regla de Hund: los electrones que pertenecen a un mismo subnivel se disponen de manera que exista el mayor número posible de electrones desapareados con el mismo valor de Espín. Cuando un orbital contiene un solo electrón se dice que esta desapareado.
Si deseas aclarar dudas o profundizar sobre el tema de modelos atómicos observa la siguiente presentación:
https://drive.google.com/file/d/1jumRTZIPh3eD5sv_cShNIum4J_w9ANSm/view?usp=sharing
EXPLICACION 2
¿Qué es el número de Avogadro?
En química, se denomina número de Avogadro o Constante de Avogadro al número de partículas constituyentes de una sustancia (normalmente átomos o moléculas) que se pueden encontrar en la cantidad de un mol de la sustancia.
El valor aceptado de esta constante es de 6,02214087 x 1023.
Se atribuye el descubrimiento de esta constante a Amadeo Avogadro, un científico italiano de inicios del siglo XIX que propuso por primera vez en 1811 que un volumen de un gas a una determinada presión y temperatura contiene la misma cantidad de átomos o moléculas, independientemente de la naturaleza misma del gas.
La utilidad de la constante de Avogadro radica en la necesidad de contar partículas o entidades microscópicas a partir de medidas macroscópicas (como la masa).
Átomo-gramo o mol de átomos: se refiere a la cantidad de átomos que hay en una cantidad de gramos igual en número a la masa atómica de un elemento concreto, dicho de otra forma: Un átomo-gramo o mol de átomos de un elemento contiene 6,022 x 1023 átomos y pesan un número de gramos igual a la masa atómica de ese elemento.
Ejemplo:
Para tener en cuenta: no olvidemos que la masa atómica se expresa en U.M.A mientras que la masa del átomo gramo o mol se expresa en gramos.
1 at-gr de Sodio 23 gramos de Sodio
1 at-gr de Sodio6,02 x 1023 átomos de sodio
23 gramos de Sodio6,02 x 1023 átomos de sodio
Para cualquier elemento químico las equivalencias son similares lo único que varía es la masa del átomo gramo, recordemos esta información la encontramos en la tabla periódica de los elementos químicos.
Masa molecular- Mole o Mol: Una molécula es la partícula unitaria de los compuestos, producto de la combinación de los átomos.
Molécula de agua Molécula de àcido acético
Los compuestos se representan mediante una formula química. La masa de una molécula, esto es su masa molecular, está dada por la suma de las masas atómicas de los átomos que constituyen la molécula. Recordemos que para este tipo de partículas microscópica la unidad es la U. M. A. y la información la obtenemos de la tabla periódica
Ejemplo:
La masa molecular de la Glucosa C6H12O6es:
Carbono12,01X6=72,06
Hidrogeno1,00X12= 12+
Oxigeno16,00X 6= 96
La mole o mol es la cantidad de sustancia que contiene 6,02 x 1023 moléculas de una sustancia.
De la misma manera podemos plantear las 3 equivalencias para cualquier compuesto.
Ejemplo:
58,45 U.M. A pesa una molécula de cloruro de sodio
1 Mol de Na Cl (cloruro de sodio) 58,45 gramos
1 Mol de Na Cl (cloruro de sodio) 6,02 x 1023 moléculas de cloruro de sodio
58,45 gramos de cloruro de sodio6,02 x 1023 moléculas de cloruro de sodio
Para cualquier compuesto químico las equivalencias son similares lo único que varía es la masa molecular, recordemos esta información la encontramos en la tabla periódica de los elementos químicos.
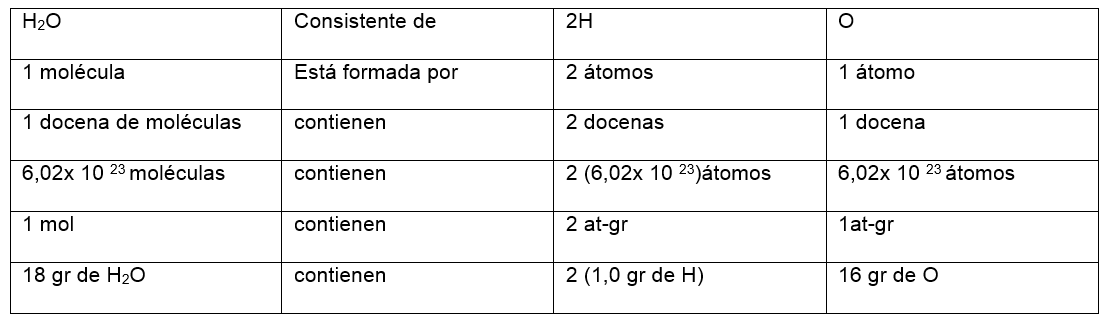
Por otra parte una formula nos permite obtener una gran cantidad de información cualitativa y cuantitativa acerca del compuesto que representa, de la fórmula del agua deducimos, por ejemplo:
Ejercicios
EJERCICIOS
1.-Completa el cuadro con los datos que aparecen allí
| Elemento | Símbolo | Z | A | Número de P+ | Número de e- | Número de n |
| Uranio |
| 92 | 232 |
|
|
|
|
| Po |
|
| 84 |
| 126 |
| Mercurio |
|
| 200 |
| 80 |
|
|
| Pt | 78 | 195 |
|
|
|
2.-El neón tiene Z= 10 y forma los isótopos de números másicos 20, 21 y 22. Indicar para cada uno, la composición del núcleo.
3.-Observa el siguiente modelo atómico del magnesio.

a. ¿Cuántas capas o niveles de energía tiene este átomo?
b. El átomo tiene 12 electrones. Sabiendo que el átomo es neutro, ¿Cuántos protones debe tener?
c. ¿Cuántos electrones tiene en total el magnesio?
d. ¿Cuántos electrones tiene el átomo en el último nivel?
e. ¿Cómo están distribuidos los 12 electrones de este átomo?
4.-Indique si cada enunciado es verdadero o falso (escriba su razón)
a. Un protón y un neutrón tienen el mismo tipo de carga eléctrica
b. Los átomos son unidades básicas de la materia
c. El número atómico de u elemento depende del número de protones que tenga en el núcleo
d. Cuando en un átomo el número de protones es igual al número de electrones, el átomo es neutro.
e. los neutrones se encuentran al igual que los electrones ubicados en el núcleo del átomo.
f. Si un átomo posee 10 protones, 8 neutrones y 10 electrones, su masa atómica será igual a 18 de acuerdo a la fórmula A=Z+N
5.-Grafica la distribución electrónica según la regla de Hund para los átomos de:
a. Nitrógeno N z=7
b. Carbono CZ=6
EJERCICIO 2
1.-Calcule la masa molecular de:
- a. Agua H2O
- b. Fosfato de calcio Ca4 (PO4)3
2.-relacione las 2 columnas
| Cantidades | Masas |
| 6,02 x 1023moléculas de hidrogeno | 18 U. M. A |
| Un átomo de oxigeno | 0.9 Gramos |
| Una mole de agua | 24U. M. A |
| Dos átomos de carbono | 1,7 x 10 -24 Gramos |
| Una molécula de agua | 18 Gramos |
| Dos átomos de carbono | 2 Gramos |
| Una molécula de agua | 6,02 x 1023Gramos |
| 2 moles de carbono | 24 Gramos |
| 1 átomo de hidrogeno | 16 U. M. A |
Evaluación
Desarrolla la evaluación que se encuentra en el siguiente enlace y publicada en el grupo de WhatsApp de la asignatura, envía la evidencia por los canales de comunicación establecidos con la docente.
https://drive.google.com/file/d/1EGel32RqEQoGOndAe1TvMlms3bG4tCdp/view?usp=sharing
1.-Completa la siguiente frase referente a las características de las t res partículas constituyentes del átomo.
La masa de protón y la del neutrón son ................................................
La carga del protón y la del electrón son .............................. y de ........................... signo.
La masa de los protones y neutrones es .................................................................... que la
del electrón, por ello podemos decir que la masa del átomo está concentrada en el ..................................
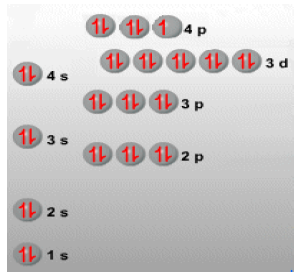
2.-La configuración electrónica de u n elemento es la distribución de sus electrones en orbitales. Esta es la configuración electrónica del bromo. Escríbela por orbitales y por capas, igual que hicimos en clase.
3.-Elementos o compuestos
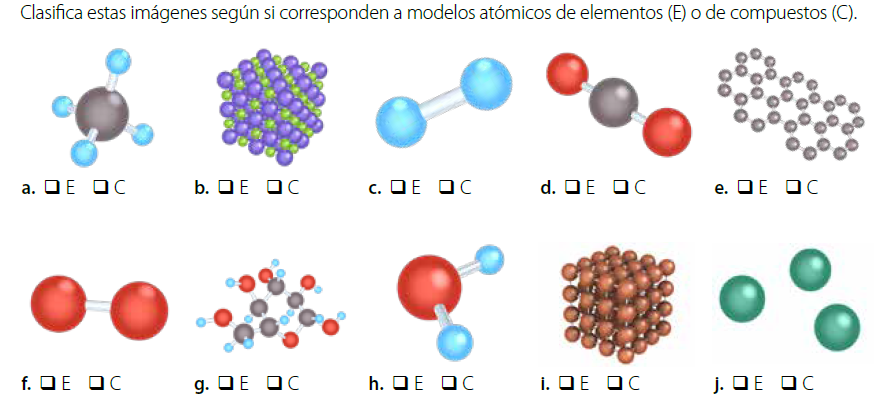
4.-La transmutación
Durante siglos, los humanos soñaron con la posibilidad de convertir metales vulgares, como el plomo, en oro.
Los alquimistas fueron los sabios que trataron de hacer ese sueño realidad. Su objetivo era lo que denominaban la transmutación de los metales. En su labor, los alquimistas experimentaron con innumerables sustancias y recopilaron datos sobre cambios y transformaciones.
Sus descubrimientos sentaron las bases de la química moderna. Y, por desgracia para ellos, fue la química moderna la que acabo con su sueño de transmutación.
En efecto, según la teoría atómica clásica, existen unas sustancias, los elementos, que son eternas e inmutables, Un elemento, como el plomo, no puede convertirse en otro elemento, como el oro. De acuerdo con esta teoría, los átomos de un elemento no se crean ni se destruyen, solamente se combinan y recombinan para formar sustancias compuestas.
Sin embargo, a principios del siglo XX, los británicos Ernest Rutherford y Frederic Soddy descubrieron algo impensable al experimentar con dos elementos descubiertos recientemente: el Torio y el Radio. ¡el Torio podía convertirse en Radio!
-Soddy: “¡Rutherford” ¡Esto es transmutación!”
-Rutherford: “¡Por lo que más quieras, Soddy, no lo llames transmutación! ¡Nos cortaran la cabeza por alquimistas!”
¿Qué estaba ocurriendo? ¿Podían tener razón los alquimistas y estar equivocados los químicos?
Science-bits.com
a. Pero a principios del siglo XX, Ernest Rutherford y Frederick Soddy observaron algo increíble. ¿Qué observaron?
b. ¿Qué sucedía con los átomos de Torio?
c. ¿Por qué este descubrimiento ponía en duda la química clásica?
d. Según la teoría atómica clásica, ¿es posible transformar unas sustancias en otras?
e. ¿Por qué los químicos clásicos menospreciaban a los alquimistas que buscaban transformar el plomo en oro?
5.- Dados los elementos de números atómicos 17, 20, 29 y 33:
a) Escriba la configuración electrónica en el estado fundamental de los elementos. Indica razonadamente, en cada caso, de qué tipo de elemento se trata y el periodo y grupo en el que se encuentra, y escribe su símbolo.
EVALUACION 2
Desarrolla cada uno de los siguientes ejercicios, no olvides que el desarrollo de cada uno de ellos debe aparecer en la evidencia que envés a través de los canales establecidos.
En 200 gramos de carbonato de calcio, Ca CO3, hay:
_________________mol de Ca CO3
_______________________moléculas de Ca CO3
_________________at-gr o mole de calcio
_________________átomos de carbono
Bibliografía
-Química 1, Hipertexto Santillana.
-Investiguemos 10. Editorial Voluntad.
-Hola Química, Editorial Susaeta
-Science-bits.com
-Fuente: https://concepto.de/numero-de-avogadro/#ixzz6qDU3j...
Foro
Acceso a las actividades
| Actividad | Nombre | Fecha de ingreso | Fecha de actualización | Número de ingresos | Año | Curso | Subreporte |
|---|---|---|---|---|---|---|---|
No results found. | |||||||
