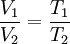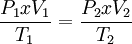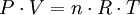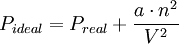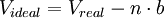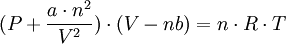| Tema | Los gases y sus leyes Énfasis |
|---|---|
| Evidencia | |
| calificable? | 1 |
| Activo | 1 |
Propósito
Que el estudiante reconozca el comportamiento de los gases, sus características y las leyes que rigen su comportamiento mediante la resolución de guías de trabajo y experimentación sencilla, de tal forma que comprenda la incidencia de los mismos en su vida y su entorno.
Motivación
Explicación
GasSe denomina gas al estado de agregación de la materia que no tiene forma ni volumen propio. Su principal composición son moléculas no unidas, expandidas y con poca fuerza de atracción, haciendo que no tengan volumen y forma definida, provocando que este se expanda para ocupar todo el volumen del recipiente que la contiene, con respecto a los gases las fuerzas gravitatorias y de atracción entre partículas resultan insignificantes. Tipos de gasesLos gases pueden clasificarse según su naturaleza química en:
Los gases presentan las siguientes propiedades:
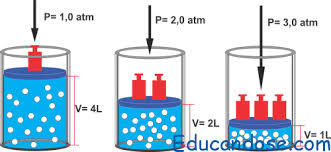
Sublimación de gasesLa sublimación es un proceso físico de cambio de fase, que permite convertir un sólido en un gas directamente, sin pasar primero por una etapa líquida. Este proceso es menos común y suele involucrar condiciones puntuales de presión y de temperatura, pero podemos observarlo en el hielo seco (o hielo de CO2) a temperatura ambiente: el bloque sólido desprende un leve vapor que no es otra cosa que la sustancia recuperando su estado gaseoso original. Evaporación de los gasesLa evaporación es un proceso de cambio de fase sumamente común, que conduce a un líquido a convertirse en gas, mediante la añadidura de energía (calor). La ponemos en práctica a diario en la cocina, cada vez que hervimos agua, por ejemplo, o en la ducha cuando el agua muy caliente se convierte en vapor observable como una nube blanquecina. Condensación de los gasesLa condensación es el proceso opuesto a la evaporación, esto es, un proceso de cambio de fase que conduce del estado gaseoso al líquido, debido a la pérdida de energía calórica. Esta energía perdida hace que las partículas del gas vibren más despacio, permitiéndoles aproximarse y enlazarse más estrechamente, como ocurre sobre un vidrio frío en día lluvioso, o sobre las plantas y otras superficies con el rocío. Sublimación inversa de los gasesLa sublimación inversa, como su nombre lo indica, es el camino opuesto de la sublimación, o sea, el paso del estado gaseoso al estado sólido sin pasar primero por un momento de liquidez. Este proceso requiere de condiciones de presión y temperatura muy específicas. Cuando las sustancias puras en estado gaseoso se solidifican en forma de cristales, se denomina cristalización. Es el caso de los cristales de hielo que caen durante las nevadas. Existen diversas leyes que relacionan la presión, el volumen y la temperatura de un gas. Ley de Boyle - MariotteCuando el volumen y la presión de una cierta cantidad de gas es mantenida a temperatura constante, el volumen será inversamente proporcional a la presión: V=KP (Donde K es constante si la temperatura y la masa del gas permanecen constantes). Cuando aumenta la presión, el volumen disminuye; si la presión disminuye el volumen aumenta. El valor exacto de la constante k , no es necesario conocerlo para poder hacer uso de la Ley; si consideramos las dos situaciones, manteniendo constante la cantidad de gas y la temperatura, deberá cumplirse la relación:
Ley de AvogadroEs aquella en el que las constantes son Presión y Temperatura, siendo el Volumen directamente proporcional al Número de moles (n) matemáticamente, la fórmula es: Ley de CharlesA una presión dada, el volumen ocupado por un gas es directamente proporcional a su temperatura. Matemáticamente la expresión:
Ley de Gay-LussacLa presión de un gas que se mantiene a volumen constante, es directamente proporcional a la temperatura: Es por esto que para poder envasar gas, como gas licuado, primero se ha de enfriar el volumen de gas deseado, hasta una temperatura característica de cada gas, a fin de poder someterlo a la presión requerida para licuarlo sin que se sobrecaliente, y, eventualmente, explote. Ley de los gases idealesArtículo principal: Ley de los gases ideales Las tres leyes mencionadas pueden combinarse matemáticamente en la llamada ley general de los gases. Su expresión matemática es: siendo P la presión, V el volumen, n el número de moles, R la constante universal de los gases ideales y T la temperatura en Kelvin. El valor de R depende de las unidades que se estén utilizando:
De esta ley se deduce que un mol de gas ideal ocupa siempre un volumen igual a 22,4 litros a 0 °C y 1 atmósfera. También se le llama la ecuación de estado de los gases; ya que solo depende de el estado actual en que se encuentre el gas.
Gases finalesSi se quiere afinar más o si se quiere medir el comportamiento de algún gas que escapa al comportamiento ideal habrá que recurrir a las ecuaciones de los gases reales que son variadas y más complicadas cuanto más precisas. Los gases reales no se expanden infinitamente, sino que llegaría un momento en el que no ocuparían más volumen. Esto se debe a que entre sus átomos/moléculas se establecen unas fuerzas bastante pequeñas, debido a los cambios aleatorios de sus cargas electrostáticas, a las que se llama fuerzas de Van der Waals. El comportamiento de un gas suele concordar más con el comportamiento ideal cuanto más sencilla sea su fórmula química y cuanto menor sea su reactividad, tendencia a formar enlaces. Así, por ejemplo, los gases nobles al ser monoatómicos y tener muy baja reactividad, sobre todo el helio, tendrán un comportamiento bastante cercano al ideal. Les seguirán los gases diatómicos, en particular el más liviano hidrógeno. Menos ideales serán los triatómicos como el dióxido de carbono, el caso del vapor de agua aún es peor ya que la molécula al ser polar tiende a establecer puentes de hidrógeno lo que aún reduce más la idealidad. Dentro de los gases orgánicos el que tendrá un comportamiento más ideal será el metano perdiendo idealidad a medida que se engrosa la cadena de carbono. Así el butano es de esperar que tenga un comportamiento ya bastante alejado de la idealidad. Esto es porque cuanto más grande es la partícula fundamental constituyente del gas, mayor es la probabilidad de colisión e interacción entre ellas, factor que hace disminuir la idealidad. Algunos de estos gases se pueden aproximar bastante bien mediante las ecuaciones ideales mientras que en otros casos hará falta recurrir a ecuaciones reales muchas veces deducidas empíricamente a partir del ajuste de parámetros. También se pierde la idealidad en condiciones extremas, altas presiones o bajas temperaturas. Por otra parte, la concordancia con la idealidad puede aumentar si trabajamos a bajas presiones o altas temperaturas. También por su estabilidad química. Comportamiento de los gasesPara el comportamiento térmico de partículas de la materia existen cuatro cantidades medibles que son de gran interés: presión, volumen, temperatura y masa de la muestra del material. Cualquier gas se considera como un fluido, porque tiene las propiedades que le permiten comportarse como tal. Sus moléculas, en continuo movimiento, logran colisionar las paredes que los contiene y casi todo el tiempo ejercen una presión permanente. Como el gas se expande, la energía intermolecular (entre molécula y molécula) hace que un gas, al ir añadiéndole energía calorífica, tienda a aumentar su volumen. Un gas tiende a ser activo químicamente debido a que su superficie molecular es también grande, es decir entre cada partícula se realiza mayor contacto, haciendo más fácil una o varias reacciones entre las sustancias. Para entender mejor el comportamiento de un gas siempre se realizan estudios con respecto al gas ideal aunque este en realidad nunca existe y las propiedades de este son:
Para explicar el comportamiento de los gases, las nuevas teorías utilizan tanto la estadística como la teoría cuántica, además de experimentar con gases de diferentes propiedades o propiedades límite, como el UF6, que es el gas más pesado conocido. Un gas no tiene forma ni volumen fijo; se caracteriza por la casi nula cohesión y a la gran energía cinética de sus moléculas, las cuales se mueven. Ecuación de van der WaalsPara estudiar los gases reales con mayor exactitud, es necesario modificar la ecuación del gas ideal, tomando en cuenta las fuerzas intermoleculares y los volúmenes moleculares finitos. Este tipo de análisis fue realizado por primera vez por el físico holandés L.D. van der Waals en 1973. además de ser un procedimiento matemático simple, el análisis de van der Waals proporciona una interpretación del comportamiento del gas real a nivel molecular. Cuando una molécula particular se aproxima hacia la pared de un recipiente, las atracciones intermoleculares ejercidas por las moléculas vecinas tienden a suavizar el impacto de esta molécula contra la pared. El efecto global es una menor presión del gas que la que se esperaría para un gas ideal. Van der Waals sugirió que la presión ejercida por un gas ideal, Pideal, está relacionada con la presión experimental medida, Preal, por medio de la ecuación:
Otra corrección es la concerniente al volumen ocupado por las moléculas del gas. En la ecuación del gas ideal, V representa el volumen del recipiente. Sin embargo, cada molécula ocupa un nivel intrínseco finito, aunque pequeño, de manera que el volumen efectivo del gas se convierte en: Donde n es el número de moles del gas b es una constante. El término nb representa el volumen ocupado por n moles del gas. Tomando en cuenta las correcciones de presión y volumen, se vuelve a escribir la ecuación del gas ideal en la forma siguiente: |
Ejercicios
Un gas tiene un volumen de 2.5 L a 25 °C. ¿Cuál será su nuevo volumen si bajamos la temperatura a 10 °C?
Solución:
Solución: Primero expresamos la temperatura en kelvin:
T1 = (25 + 273) K= 298 K
T2 = (10 + 273 ) K= 283 K
Ahora sustituimos los datos en la ecuación: V1T1=V2T2
2.5L = V2
298K 283K
Y despejando:V2=2.37L
Ejmplo: se tienen 4 litros de Ar a una presión de 650 mmHg, si la presión cambia a 350 mmHg, cual será ahora el volumen del gas
DATOS
V1= 4L ArP1?V1=P2?V2
sustituimos en la fórmula que ya despejamos:
P1= 650 mm Hg
Despejar la variable V2V2 = 650 mmHg x 4L
P2= 350 mm HgV2 = P1x V1350 mmHg
V2= ?P2V2= 7.42 L
El volumen debe aumentar
Evaluación
Resolver guia anexa
GUIA LEY DE BOYLE.GRADO 11-01 ENFASIS EN CIENCIAS NATURALES I.E.T. JOAQUIN PARIS
1. Consultar biografia de Boyle
2. Hay un gas en un globo de 4.1 L y disminuye a 2.5 La presion inicial de 210 Pa. Calcular la presion final.
3. una cantidad de gas ocupa un volumen de 80 cm3 a una presion de 750 mmHg , que volumen ocupara a una presion de 1.2 atm , si la temperatura no cambia.
4. A 20°C, un recipiente contiene un gas seco X. E n el siguiente dibujo se muestra el volumen delgas a diferentes presiones.
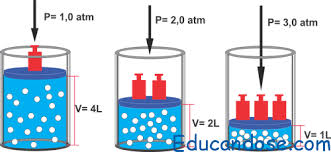
La grafica que mejor describe la variación del volumen cuando cambia la presión es
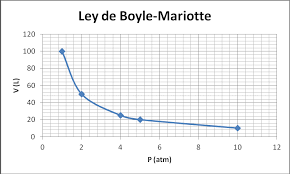
 3 , calcular la presión que debe soportar para que su volumen sea 95 cm3 .
3 , calcular la presión que debe soportar para que su volumen sea 95 cm3 .
9.A temperatura constante, la presión a que están sometidos 200 cm3 de Ne ha sido elevada desde 400 hasta 1000mm Hg .Cual es el volumen que ocupa el gas bajo la nueva presión.
10. Un gas a una temperatura de 250 °Cocupa un volumen de 8 L a una presión de 05 atm. Si la presión ahora es de 1.5 atm, cual es el nuevo volumen
Nota: enviar al correo tareas.quimicabiologia@gmail.comel próximo martes 16 de marzo hasta las 4 p.m
Bibliografía
https://www.caracteristicas.co/gases/#ixzz6p0kNgitb
https://www.caracteristicas.co/gases/#ixzz6p0lvzMHF
"Gases". Autor: Julia Máxima Uriarte. Para: Caracteristicas.co. Última edición: 9 de marzo de 2020. Disponible en: https://www.caracteristicas.co/gases/. Consultado: 13 de marzo de 2021.
Foro
Acceso a las actividades
| Actividad | Nombre | Fecha de ingreso | Fecha de actualización | Número de ingresos | Año | Curso | Subreporte |
|---|---|---|---|---|---|---|---|
| 6301 | VARGAS MARTINEZ GABRIEL ENRIQUE | 2021-03-23 11:34:59 | 2021-03-23 11:34:59 | 1 | 2021 | Tarea | |
| 6301 | VARGAS ESCOBAR SARA NICOL | 2021-03-14 19:37:24 | 2021-03-14 19:37:24 | 1 | 2021 | Propósito | |
| 6301 | VARGAS ESCOBAR SARA NICOL | 2021-03-14 19:37:27 | 2021-03-14 19:37:27 | 1 | 2021 | Motivación | |
| 6301 | VARGAS ESCOBAR SARA NICOL | 2021-03-14 19:37:31 | 2021-03-14 19:37:31 | 1 | 2021 | Explicación |


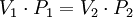
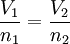
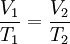 o
o