| Tema | Configuración Electrónica Énfasis |
|---|---|
| Evidencia | |
| calificable? | 1 |
| Activo | 1 |
Propósito
Identifica la distribución electrónica por niveles de energía, sus componentes y su influencia en los avances científicos actuales mediante resolución de guía de trabajo alusiva al tema para tener herramientas reflexivas frente a los pro y contra del avance científico y su influencia en el mundo actual
Motivación

Explicación
Configuración electrónica
Comúnmente, la configuración electrónica se utiliza para describir los orbitales de un átomo en su estado fundamental, pero también puede usarse para representar un átomo que se ha ionizado en un catión o anión, compensando con la pérdida o ganancia de electrones en sus respectivos orbitales.
Muchas de las propiedades físicas y químicas de los elementos pueden correlacionarse con sus configuraciones electrónicas únicas. Los electrones de valencia, los electrones en la capa más externa, son el factor determinante para la química única del elemento.Para realizar la notación espectral de un elemento se deben tener en cuenta los siguientes principios:
1. principio Aufbau.
Los electrones se reúnen alrededor del núcleo en orbitales cuánticos siguiendo cuatro reglas básicas llamadas principio Aufbau.
1.No hay dos electrones en el átomo que comparten los mismos cuatro números cuánticos n, l, m, y s.
2.Los electrones ocuparán primero los orbitales del nivel de energía más bajo.
3.Los electrones irán llenando los orbitales siempre con el mismo número de spin. Cuando los orbitales estén llenos comenzará.
4.Los electrones llenarán orbitales por la suma de los números cuánticos n y l. Los orbitales con valores iguales de (n + l) se llenarán primero con los valores de n inferiores.
2. Regla de hund: La regla de Hund es un método empírico utilizado para el llenado de orbitales que posea igual energía. Dicha regla fue acuñada por el físico alemán Friedrich Hund, y es conocida también bajo el nombre de regla de máxima multiplicidad de Hund.

3. Principio de exclusión de Pauli: es una regla de la mecánica cuántica, enunciada por Wolfgang Ernst Pauli en 1925. Establece que no puede haber dos fermiones con todos sus números cuánticos idénticos dentro del mismo sistema cuántico.
Z : número atómico: ( electrones, protones, neutrones)
Configuración electrónica: distribuir electrones por niveles de energía.

Números cuánticos:
Se relacionan con nivel de energía, forma del espacio donde están los electrones, tipo de giro o momento magnético, dirección del electrón.
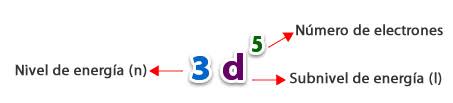
1. Número cuántico principal: Antes llamado principal o radial. Se relaciona con la magnitud del volumen ocupado por el orbital en el cual se localiza el electrón diferencial, se denomina n y adquiere valores enteros positivos: 1, 2, 3, 4, etc. (éstos son los niveles de energía principales).
2. Orbitales: También es conocido como el número cuántico del momento angular orbital o número cuántico azimutal y se simboliza como ? (L minúscula).
Describe la forma geométrica del orbital. Los valores de l dependen del número cuántico principal. Puede tomar los valores desde ? = 0 hasta ? =n-1. Por ejemplo:
si n = 2 ; ? = 0, 1.
si n = 4 ; ? = 0, 1, 2, 3.
En el caso de los átomos con más de un electrón, determina también el subnivel de energía en el que se encuentra un orbital, dentro de un cierto nivel energético. El valor de l se designa segun las letras: s,p,d,f ( espacios donde existe la probabilidad de encontrar un electrón).Tenemos 4 tipos de orbitales:
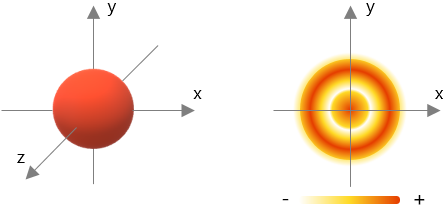
1. Orbital S: Tiene una dirección de giro y una capacidad máxima de 2 electrones:
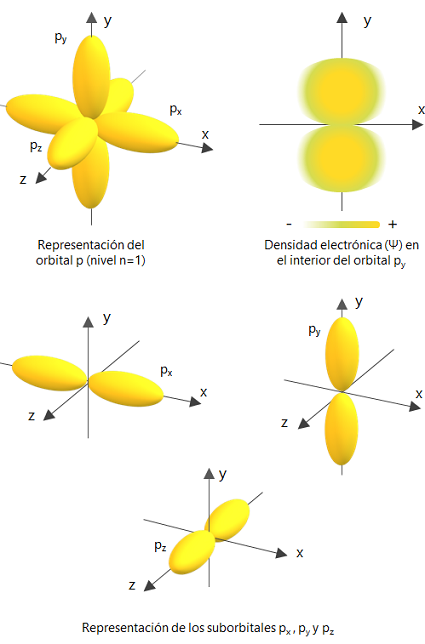
2. Orbital P: tiene 3 direcciones de giro (de acuerdo a los ejes del plano cartesiano) y una capacidad máxima de 6 electrones
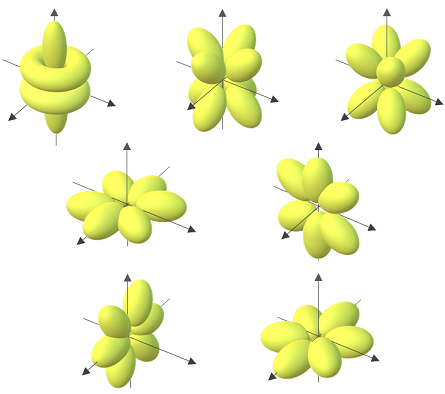
3. Orbital d: tiene 5 direcciones de giro y una capacidad máxima de 10 electrones:

4 .Orbital f: tiene 7 direcciones de giro con una capacidad máxima de 14 electrones
3. Número cuántico magnético: Se relaciona con el número y las posibilidades de orientación espacial de los orbitales factibles de ser ocupados por el electrón diferencial. Los valores permitidos para este número van desde –l, pasando por 0, hasta +l.
4. numero cuántico spin: Se relaciona con la posibilidad de que un orbital, previamente ocupado por un electrón, acepte o no al electrón diferencial. Este número cuántico sólo puede adquirir dos valores: + ½ y - ½.
Diagrama Moller : es indispensable para realizar la configuración electrónica. Y se utiliza de acuerdo a la ley de las diagonales (de la cola de la flecha hacia la punta de la flecha y utilizando los términos que hallan en la misma)
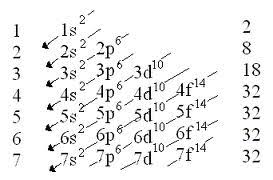
tomando un termino de la notación espectral tenemos la siguiente información:
Ubicación de un elemento químico de acuerdo a su notación espectral: Cuando la notación espectral de un elemento termina en:
S1 : Grupo IA
S2: Grupo IIA
P1: : grupo IIIA
P2: grupo IV A
P3: grupo VA
P4: Grupo VIA
P5: Grupo VIIA
P6: Grupo VIII.A
Cuando la notación espectral termina en sd el elemento pertenece a la región B de la tabla periódica.Se suman los electrones que hay en los últimos términos (s y d), y este nos indica el grupo donde se ubica el elemento en mención.
Ejm: realizar la notación espectral para el siguiente elemento.Indique a que grupo y periodo pertenece (nombre- símbolo- peso atómico)
Z= 17:1s22s22p63s23p5
Grupo: VIIA .Periodo: 3.
Nombre: Cloro
Símbolo: Cl
Peso atómico: 35.45 u.m.a
Actividad:para los siguientes Z, realizar la notación espectral, indicar grupo, periodo, símbolo, nombre, peso atómico
1. Z= 15
2. Z= 25
3. Z= 6
4. Z= 11
5. Z= 14
6.Z= 52
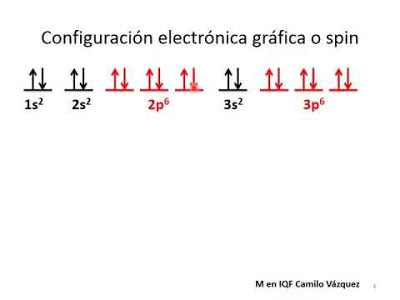
La notación espectral se puede graficar de dos formas:
1. Mostrando los electrones en forma de spin
2.tomando el modelo de Bohr:

Ejercicios
Realizar la notación espectral, ubicación del elemento en grupo y periodo, realizar los dos gráficos de la distribución electrónica
para los siguientes Z
1.Z= 20
2. Z= 30
3.Z=4
4. Z= 16
5 .Z= 12
Evaluación
Se envia taller colombia aprende
y enlace en quiz
Bibliografía
Foro
Acceso a las actividades
| Actividad | Nombre | Fecha de ingreso | Fecha de actualización | Número de ingresos | Año | Curso | Subreporte |
|---|---|---|---|---|---|---|---|
| 5741 | MARIA ALEJANDRA ORJUELA SANCHEZ | 2021-03-17 09:03:11 | 2021-03-17 09:03:11 | 1 | 2021 | Tarea |
