| Tema | Distribución Electrónica |
|---|---|
| Evidencia | |
| calificable? | 0 |
| Activo | 0 |
Propósito
Identifica la distribución electrónica por niveles de energía, sus componentes y su influencia en los avances científicos actuales mediante resolución de guía de trabajo alusiva al tema para tener herramientas reflexivas frente a los pro y contra del avance científico y su influencia en el mundo actual
Motivación
Explicación
La notación espectral es la disposición de electrones en niveles de energía alrededor del núcleo de un átomo. Según el antiguo modelo atómico de Bohr, los electrones ocupan varios niveles en órbitas alrededor del núcleo, de la primera capa más cercana al núcleo, K, hasta la séptima capa, Q, que es la más alejada del núcleo. En términos de un modelo mecánico cuántico más refinado, las capas K-Q se subdividen en un conjunto de orbitales, cada uno de los cuales puede ser ocupado por no más de un par de electrones.

Comúnmente, la configuración electrónica se utiliza para describir los orbitales de un átomo en su estado fundamental, pero también puede usarse para representar un átomo que se ha ionizado en un catión o anión, compensando con la pérdida o ganancia de electrones en sus respectivos orbitales.
Muchas de las propiedades físicas y químicas de los elementos pueden correlacionarse con sus configuraciones electrónicas únicas. Los electrones de valencia, los electrones en la capa más externa, son el factor determinante para la química única del elemento.
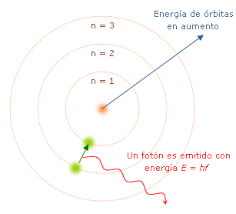
Cuando los electrones de la capa más externa de un átomo reciben energía de algún tipo, estos se trasladan a capas de mayor energía. Así, un electrón en la capa K será trasladado a la capa L estando en un estado de mayor energía.
Cuando el electrón regresa a su estado fundamental, libera la energía que absorbió emitiendo un espectro electromagnético (luz). Dado que cada átomo tiene una configuración electrónica específica, también tendrá un espectro específico que se llamará espectro de absorción (o de emisión).
Por esta razón, se usa el término notación espectral para referirse a la configuración electrónica.
Números Cuánticos: : Para describir las características de un electrón situado en un determinado orbital, se necesitan cuatro números cuánticos, que se representan mediante las letras n, l, m.
Los números cuánticos son importantes porque pueden usarse para determinar la configuración electrónica de un átomo y la probable ubicación de los electrones del átomo. Hay un total de cuatro números cuánticos: el número cuántico principal (n), el número cuántico del momento angular orbital (l), el número cuántico magnético (ml) y el número cuántico del spin del electrón (ms).
El número cuántico principal, n, describe la energía de un electrón y la distancia más probable del electrón del núcleo. En otras palabras, se refiere al tamaño del orbital y al nivel de energía en que se coloca un electrón.
El número de subcapas, o l, describe la forma del orbital. También puede usarse para determinar el número de nodos angulares.
El número cuántico magnético, ml, describe los niveles de energía en una subcapa, y ms se refiere al spin sobre el electrón, que puede ser hacia arriba o hacia abajo.
Principio de Aufbau
Aufbau proviene de la palabra alemana “Aufbauen” que significa “construir”. En esencia, al escribir configuraciones de electrones estamos construyendo orbitales de electrones a medida que avanzamos de un átomo a otro.
El principio de Aufbau se origina en el principio de exclusión de Pauli
Los electrones se reúnen alrededor del núcleo en orbitales cuánticos siguiendo cuatro reglas básicas llamadas principio Aufbau.
1.No hay dos electrones en el átomo que comparten los mismos cuatro números cuánticos n, l, m, y s.
2.Los electrones ocuparán primero los orbitales del nivel de energía más bajo.
3.Los electrones irán llenando los orbitales siempre con el mismo número de spin. Cuando los orbitales estén llenos comenzará.
Los electrones llenarán orbitales por la suma de los números cuánticos n y l. Los orbitales con valores iguales de (n + l) se llenarán primero con los valores de n inferiores

La distribución de electrones se realiza de acuerdo al diagrama de Moller, en el cual se aprecian claramente los niveles de energía, los orbitales, máximo de electrones por nivel de energía ;
- El gráfico se lee ejecutando las diagonales desde 1s. y las flechas indican el camino y dirección a seguir .
. A continuación observemos un término de la notación espectral y el significado de cada termino
ORBITALES: Un orbital atómico es la región del espacio definido por una determinada solución particular, espacial e independiente del tiempo a la ecuación de Schrödinger para el caso de un electrón sometido a un potencial coulombiano.
De esta manera, los electrones se distribuyen por el espacio en orbitales que son las regiones con una alta probabilidad de encontrarlos.
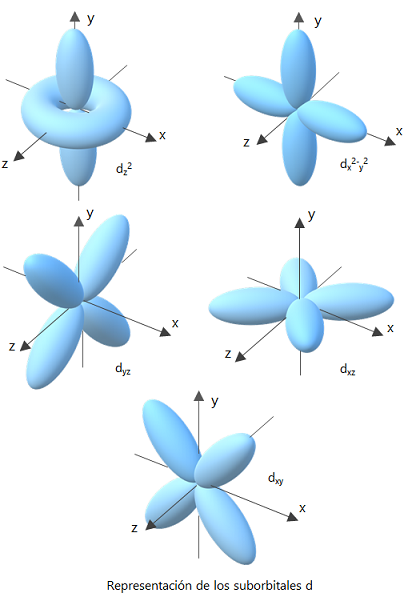
de acuerdo a la forma los orbitales se clasifican :
Orbital F
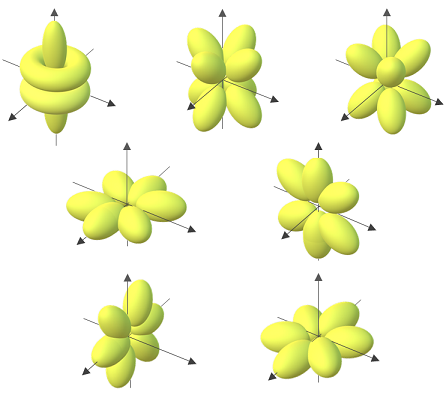
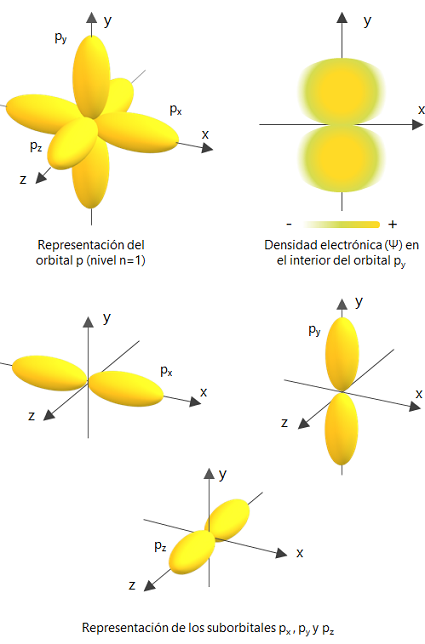
el grafico anterior orbital P
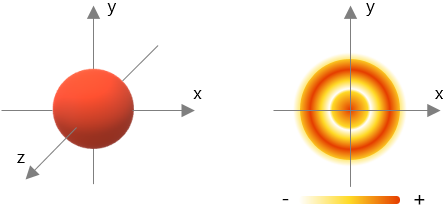
y los siguientes en orden, orbital S y orbital d
Regla de Hund: En física atómica, las reglas de Hund se refieren a un conjunto de reglas simples utilizadas para determinar cual es el estado espectroscópico fundamental del átomo estudiado. Las tres reglas son:
1.para una configuración electrónica dada, el término de menor energía es aquel que tenga el mayor espín total (St);
2.para un espín total dado, el término de más baja energía es aquel que tiene el número L más grande;
3.para un término de espectroscopia dado, en un átomo teniendo su capa externa medio llena o menos, el nivel de menor energía será el que tenga el menor número J posible. En un átomo que tenga su capa externa más que medio llena, el nivel de menor energía es aquel que tenga el mayor número J posible.
Al aplicarse estas reglas se obtiene la configuración electrónica del átomo, que suele escribirse mediante la notación abreviada de los electrones contenidos en cada subnivel:
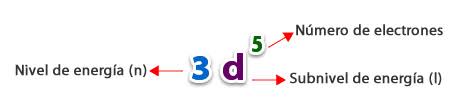
nXy
donde n es el número cuántico principal, X la letra correspondiente al número cuántico secundario (l) e y es el número de electrones que contiene ese subnivel.
La configuración electrónica de un átomo vendrá dada por el siguiente orden de llenado, en el que se indica la capacidad electrónica máxima de cada subnivel:
1s2 2s2 2p6 3s2 3p6 4s2 3d10 4p6 5s2 4d10 5p6
Para encontrar la configuración electrónica de un átomo en concreto bastará con ir colocando sus electrones, siguiendo este orden de llenado.
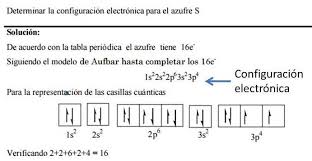
Escribe la configuración electrónica del átomo de azufre (Z = 16)
Como el número atómico del azufre es 16, un átomo neutro de oxigeno tendrá 16 e- a colocar en los orbitales. Según el orden de llenado, la configuración electrónica del azufre será
| |
| |
Escribe la configuración electrónica del litio y del potasio, de la misma forma que has hecho con la del sodio. Compara las tres estructuras y obtén una conclusión conjunta.
Li: 1s2 2s1
Na: 1s2 2s2 2p6 3s1
K: 1s2 2s2 2p6 3s2 3p6 4s1
Los tres átomos tienen un electrón en la capa más externa: la segunda en el de Li, la tercera en el de Na y la cuarta en el de K, que están situados en un orbital del tipo s.
Ejercicios
Realizar la notacion espectral para los siguientes z
1. z= 8
2.z=15
3. z= 25
4.Z= 35
5. z= 10
observe los siguientes videos que le permitiran aclarar dudas
https://www.youtube.com/watch?v=ne2EDURtj5I&ab_channel=JavierVald%C3%A9sG%C3%B3mezdistribución de electrones
configuración electrónica muy buenohttps://www.youtube.com/watch?v=8mzYicLUHxQ&ab_channel=JavierVald%C3%A9sG%C3%B3mez
https://www.youtube.com/watch?v=Fo8Mi4TEozI&ab_channel=LaQu%C3%ADmicadeYamil
Evaluación
se subira enlace quizz
Bibliografía
Foro
Acceso a las actividades
| Actividad | Nombre | Fecha de ingreso | Fecha de actualización | Número de ingresos | Año | Curso | Subreporte |
|---|---|---|---|---|---|---|---|
No results found. | |||||||
