| Tema | Generalidades de la química |
|---|---|
| Evidencia | |
| calificable? | 0 |
| Activo | 1 |
Propósito
GUÍA#3:
Que el estudiante comprenda, analice y explique la composición y características de los átomos, teniendo en cuenta las partículas que los componen. Además que relacione la contaminación ambiental con el mal uso que se le da a los residuos químicos y reflexione sobre ello.
Motivación
A continuación se muestra una imagen debes dibujarla en el cuaderno de química y escribir una reflexión sobre ella, teniendo en cuenta la relación de la química con el fenómeno observado:

Explicación
Algunas propiedades de los átomos
Lectura adaptada de Colombia aprende
Como ya sabes, los primeros modelos atómicos proponían la existencia de tres clases de partículas subatómicas (partículas que se encuentran formando el átomo): protones, neutrones y electrones. Los avances de la química a través de los siglos han permitido establecer hoy en día que dichas partículas subatómicas están formadas a su vez por otras más pequeñas. Hablamos de partículas bosónicas, como los fotones, gluones y piones.
Los protones y neutrones están formados por quarks reunidos. Los quarks combinan partículas llamadas gluones. Se reconocen seis diferentes tipos de quarks y una gran cantidad de partículas subatómicas. Sin embargo, las características físicas y químicas de los átomos se siguen reconociendo a través de las tres partículas subatómicas fundamentales: los protones (p) (carga positiva), los neutrones (n) (sin carga) y los electrones (e) (carga negativa). Los dos primeros se encuentran formando el núcleo y el tercero se ubica en su periferia.
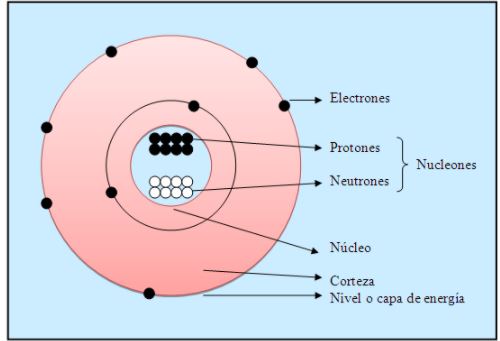
Hoy sabemos por ejemplo, que algunas de las propiedades físicas como el punto de fusión, el punto de ebullición, el color o la dureza, están determinadas por los electrones. Así, de acuerdo con la cantidad de estas partículas (protones, neutrones y electrones), un átomo presenta propiedades que lo caracterizan: el número atómico, el número de masa, masa atómica e isótopos.
Número atómico (Z): cantidad de cargas positivas que hay en el núcleo de un átomo. En átomos neutros este número coincide con el número de electrones. Se representa con la letra (Z). Por ejemplo: el oxígeno (O) presenta un número atómico de 8, entonces es correcto decir que tiene 8 protones en su núcleo y 8 electrones en la periferia (Z = 8).
Número de masa (A): dado que la masa de un electrón es demasiado pequeña comparada con la masa de los protones y los neutrones, no es considerada para calcular la masa de un átomo. Así, el número de masa de un átomo es la suma de protones y neutrones. Se representa con la letra A. Por ejemplo: A = protones + neutrones.
El oxígeno (O) = 8 protones + 8 neutrones, entonces: A= 8 + 8 = 16. A=16 Isótopos: estos son átomos de un mismo elemento, cuyos núcleos presentan el mismo número atómico (Z), pero diferente número de masa (A). Esto significa que en su núcleo tiene el mismo número de protones, pero el número de neutrones es diferente. En la naturaleza son muchos los elementos que presentan isótopos. Por ejemplo, en estado natural, el oxígeno es una mezcla de isótopos, en la cual el 99, 8% corresponde a átomos con A = 16 (Z = 8 y N = 8), mientras que el 0,037% tiene A = 17 (Z = 8 y N = 9) y el 0,204% posee A = 18 (Z = 8 y N = 10). Se representa así:

Masa atómica: como la masa de un átomo es tan pequeña, alrededor de 10-24 g, se han calculado las masas atómicas relativas de los átomos con relación a un patrón de medida. Este patrón es la doceava parte del átomo de carbono de número másico 12. El número de referencia es de 12.000 unidades de masa atómica (uma o simplemente u). La masa atómica hace referencia entonces, al cálculo de las abundancias relativas de los isótopos de un elemento a partir del número de masa del carbono 12.
Siendo una u.m.a. = 1,67 X10-24 g
Por ejemplo:
Si se establece que un átomo de oxígeno tiene una masa atómica de 15,99… uma, quiere decir que la masa atómica de un átomo de oxígeno es 15,99… veces mayor que la doceava parte de átomo de carbono 12, ya que la masa atómica de este isótopo es de 12 uma.
En Síntesis: El número atómico es importante porque es el que le da identidad al elemento y se establece con el número de protones presentes en el núcleo de un átomo. Indica además, el número de electrones presentes en la periferia. Entre tanto el número de masa representa el número total de protones y neutrones presentes en el núcleo del átomo y la masa atómica hace referencia al promedio de abundancias relativas de los átomos de un mismo elemento.
Número atómico: Z = número de protones o electrones en átomos neutros.
Número de masa: A = Z + N
Donde A representa el número de masa, Z el número atómico y N el número de neutrones.
Ejercicios
En tu cuaderno de química:
1. Dibuja las estructuras relacionadas en la lectura. Utiliza colores.
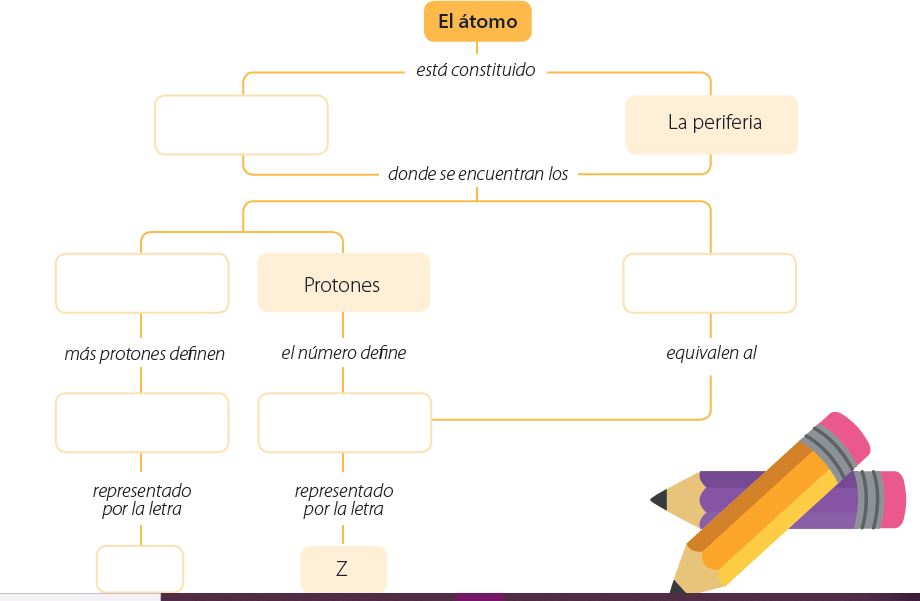
2. realiza el siguiente mapa conceptual y compleméntalo:
Evaluación
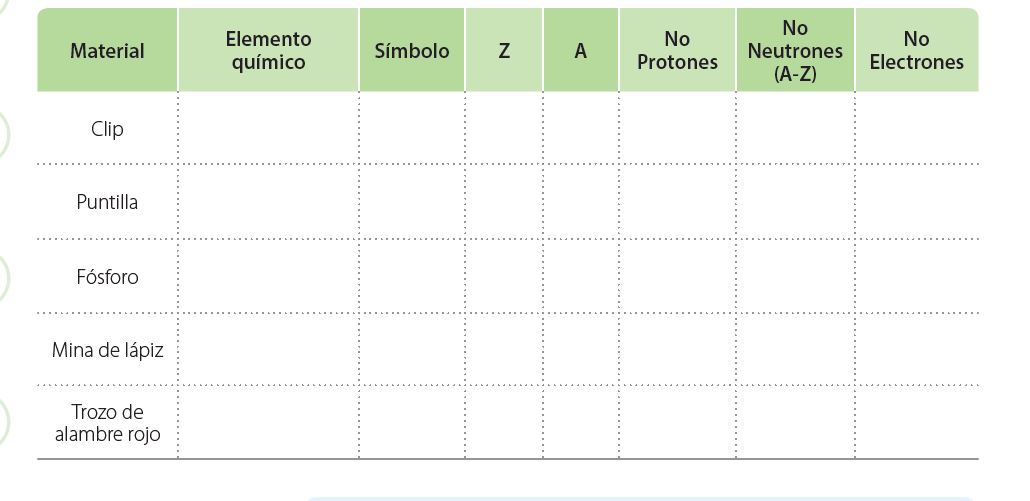
Realiza el siguiente cuadro en tu cuaderno de química y compleméntalo, para ello la explicación de la guía, del docente y tu buena interpretación es fundamental:
Bibliografía
Foro
Cursos
| Curso | |
|---|---|
No results found. | |
Acceso a las actividades
| Actividad | Nombre | Fecha de ingreso | Fecha de actualización | Número de ingresos | Año | Curso | Subreporte |
|---|---|---|---|---|---|---|---|
No results found. | |||||||
