| Tema | Soluciones |
|---|---|
| Evidencia | |
| calificable? | 1 |
| Activo | 1 |
Propósito
Distingue los conceptos de solución y solubilidad para utilizar las unidades físicas y químicas de concentración en la resolución de problemas y los relaciona con los niveles de pH determinados teóricamente para así explicar su influencia en eventos cotidianos.
Motivación
¿Cómo preparamos un refresco para que quede bueno de dulce?
Las soluciones son parte de nuestras vidas:

Tienes a tu disposición el siguiente simulador para que prepares soluciones.
En el simulador los alumnos podrán agregar al agua, diferentes compuestos sal, también podrán agregar azúcar, y, al realizar un acercamiento, observar la disolución a nivel microscópico.
La exploración y uso del simulador, permitirá construir conocimiento acerca de la formación de soluciones.
http://phet.colorado.edu/es/simulation/sugar-and-salt-solution
Explicación
Las soluciones son sistemas homogéneos (iguales propiedades físicas y químicas en toda su masa por lo tanto no se distinguen los componentes a simple vista) están constituidas básicamente por dos componentes: soluto, que se encuentra en menor proporción, y solvente, que se encuentra en mayor proporción.
- Tipos de disoluciones de acuerdo al estado de agregación que tengan.
Existen disoluciones en prácticamente todos los estados de agregación. Generalmente, el estado de agregación de la disolución queda determinado por el estado de agregación del solvente.
Los tipos de disoluciones son:
Disolución de gases en gases (gaseosa). Por ejemplo: el aire que respiramos.
Disolución de sólidos en gases (gaseosa). Por ejemplo: el polvo disuelto en el aire.
Disolución de líquidos en gases (gaseosa). Por ejemplo: el vapor de agua en el aire.
Disolución de sólidos en líquidos (líquida). Por ejemplo: la sal de mesa (NaCl) disuelta en agua.
Disolución de líquidos en líquidos (líquida). Por ejemplo: el etanol (CH3CH2OH) disuelto en agua.
Disolución de gases en líquidos (líquida). Por ejemplo: el oxígeno (O2) disuelto en agua.
Disolución de sólidos en sólidos (sólida). Por ejemplo: las aleaciones, como el bronce (aleación de cobre y estaño).
Disolución de gases en sólidos (sólida). Por ejemplo: el gas hidrógeno disuelto en paladio.
Disolución de líquidos en sólidos (sólida). Por ejemplo: las amalgamas, que son la disolución de mercurio en otros metales sólidos.
Se denomina concentración a la relación que existe entre la cantidad de soluto y la cantidad de solución o de solvente. Es un concepto muy importante, ya que basándose en dicha relación se preparan soluciones en la industria alimenticia o farmacéutica. Por ejemplo, la llamada solución fisiológica o suero fisiológico que se les administra a las personas por diferentes causas tiene exactamente 9 gramos de sal por litro de agua.
- Tipos de disoluciones de acuerdo a la concentración
Los tipos de soluciones se obtienen a través de la mezcla final que se obtenga, teniendo también diferentes comportamientos. Entonces se dice que los tipos de disoluciones son las siguientes:
Las disoluciones diluidas: Son las que tienen poco soluto en una misma medida de disolvente. Es aquella solución a la cual es posible agregar más soluto y que éste se disuelva.
Las disoluciones concentradas: En este caso estamos hablando de las que tienen una mayor concentración de soluto en una misma medida de disolvente.
Las disoluciones saturadas: Se consideran así las que pueden conseguir un equilibrio entre el disolvente y el soluto, además no puede disolver más cantidad de soluto, esto al menos en las condiciones dadas de presión y temperatura.
disoluciones sobresaturadas: Ahora corresponde hablar de las que son llevadas mucho más allá de su borde, en cuanto a la saturación. Esto se consigue al manipular la temperatura y la presión. Cuando estas alteraciones ocurren, entonces estamos frente a un sistema el cual es totalmente inestable.
La concentración se puede expresar de distintas maneras:
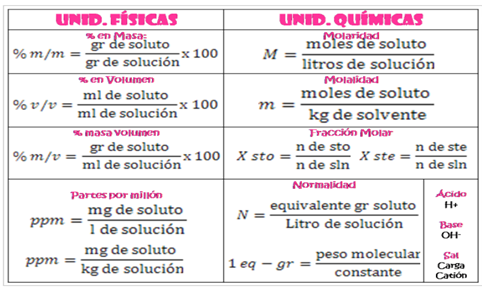


DISOCIACIÓN DEL AGUA
El agua es un electrolito débil y es capaz de disociarse en una proporción muy escasa y originar tanto H+ como OH-
Según la ley de acción de masas (LAM):
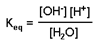
Como la concentración del agua no disociada es muy grande (55,5 M) y permanece prácticamente inalterada, su valor se incluye en la constante, que pasa a llamarse producto iónico del agua (Kw):
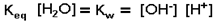
El valor de Kw, medido a 24º C es 10-14 moles2 litro-2. Como este valor es constante, las concentraciones de H+ y OH- guardan una relación inversa: si una de ellas aumenta, la otra disminuye.
En el agua pura ambas concentraciones son iguales:
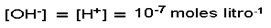
Como [H2O]= 55,5 M y [H+]=10-7 M, esto quiere decir que en el agua pura una de cada 555 millones de moléculas está disociada.
¿Qué
es el pH?
El pH es una medida de acidez o alcalinidad de una disolución acuosa. El pH indica la concentración de iones de hidrógeno presentes en determinadas disoluciones. La sigla significa potencial de hidrógeno o potencial de hidrogeniones.
La fórmula matemática para calcular el pH es el logaritmo negativo en base 10 de la actividad de los iones hidrógeno. pH = –log[H+] Es decir, será más ácido cuanta más actividad con cargas positivas de Hidrógeno exista en la disolución. Cuando haya menos actividad la muestra, será alcalina.
¿Como se mide el PH?
El pH normalmente lo medimos en una escala de 1 a 14. El uno sería el valor más ácido. El 14 el valor más alcalino. Y el 7 el valor neutro. Normalmente se usan 2 tipos de instrumentos para medir el pH.
El valor del pH se puede medir de forma precisa mediante un potenciómetro, también conocido como pH-metro
También se puede medir de forma aproximada el pH de una disolución empleando indicadores, ácidos o bases débiles que presentan diferente color según el pH, como la fenolftaleína. Generalmente se emplea papel indicador, que se trata de papel impregnado de una mezcla de indicadores.

Importancia de medir el pH
El pH es la más común de todas las mediciones durante los procesos industriales, asimismo desempeña un papel importante en el procesamiento de alimentos, agricultura, acuicultura, entre otras industrias. Las razones por las que es importante usar un medidor de pH destacan las siguientes:
- Para producir productos con propiedades coherentes y bien definidas.
- Para producir productos de manera eficiente a un costo óptimo.
- Evitar problemas de salud en los consumidores.
- Cumplir con los requisitos reglamentarios.
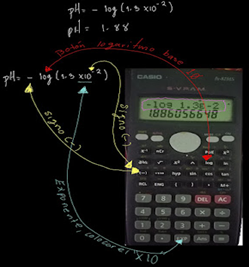
Ejemplo: Calcula el pH de una solución de HF (Acido fluorhídrico) de 1.3X10-2M
Debemos entender que el HF es un ácido, por tanto, su pH debe ser menor a 7
Para aclarar dudas sobre ejercicios para calcular pH o pOH observa el siguiente tutorial https://youtu.be/BeB_-Ch-G8Q?t=185
Ten en cuenta como se realiza la operación en la calculadora
Para aclarar dudas sobre este tema puedes observar la siguiente presentación en power point
Ejercicios
Resuelve los siguientes ejercicios, no olvides hacer la demostración numerica en cada caso:
1.- Disolvemos 45 gramos de amoniaco NH3 en 500 gramos de agua. Calcula el porcentaje en masa de la disolución.
2.- - Se disuelven 20 = g de hidróxido de sodio NaOH en 560 g de agua. Calcula
a) la concentración de la disolución en % en masa
b) su molalidad. (Na) 23. (O)=16. (H)=1.
3.- Se desea preparar 200 mL de solución de C6H12O6 al 15% m/v. ¿Cuántos mL de este compuesto debe disolverse?
4.- Calcule la concentración molar de 40 g de CH4 (metano) de masa molar 16,04 g/mol, en 200 mL de mezcla
Evaluación
Realiza la lectura y desarrollo los problemas planteados:
CALI LA CIUDAD DE LOS SIETE RÍOS
El municipio de Santiago de Cali hasta hace aproximadamente 35 años fue considerado como una ciudad con un recurso hídrico alto, dado que gozaba con la fortuna de estar regada por 7 fuentes hídricas, las cuales les suministraba volumen alto de agua potable a sus habitantes para que pudieran suplir sus necesidades primarias. Adicionalmente, estas cuencas servían para que los caleños disfrutaran los fines de semana de estos sitios ecológicos, a través de los paseos de olla.
Ahora bien, la población actual de Santiago de Cali sólo reconoce dos de los sietes ríos del municipio, a saber: el PANCE por la utilización que de él se hace como el principal sitio de recreación, y el río Cali, porque éste al atravesar el municipio se ha convertido en un hito para la ciudad. Quizás, otros nombres de ríos como: CAÑAVERALEJO, LILI, AGUACATAL Y MELENDEZ, las nuevas generaciones de caleños los identifican más como barrios que como afluentes.
De hecho, la comunidad académica ha considerado que estos ríos hace aproximadamente cuatro décadas poseían las condiciones físicas y químicas óptimas para la vida de múltiples especies de organismos, no obstante, en los actuales tiempos estas fuentes hídricas y ecosistémicas han sufrido una involución en sus propiedades fisicoquímicas, es decir, se han convertido en caños de agua negras, posiblemente a causa de un desarrollo urbano no planificado de nuestra ciudad, además, de la poca producción limpia de las industrias que se radicaron en nuestro territorio hace cuarenta años, las cuales arrojan sus desechos tóxicos a las diferentes cuencas de nuestro territorio. La anterior situación ha hecho que las nuevas generaciones de caleños observen estas fuentes hídricas más como un fluido de aguas negras o de alcantarillado que como ríos de agua potable. En tanto al río CAUCA, es el segundo más importante de Colombia, y salvo por quienes viven cerca de sus riberas, esta característica hace recordarlo más como parte del país que del municipio, de ahí que el eslogan, “Cali la ciudad de los siete ríos”, ya no aplique a nuestro territorio.
En este sentido, afirmamos que el recurso hídrico de nuestro municipio de Santiago de Cali de manera progresiva se ha venido agotando, así pues, que únicamente nos queda los ríos PANCE, CALI Y CAUCA, para una población que cuyo crecimiento es exponencial. Ahora bien, los análisis bioquímicos de nuestras aguas, han arrojado resultados poco alentadores, de hecho, se declara que estas fuentes hídricas poseen altas concentraciones de: pesticidas, desechos químicos (hidrocarburos, benceno), metales pesados (mercurio, arsénico), residuos radiactivos (radio, polonio), gasolina, aceites de motor etc., los cuales hacen que éstas sean peligrosas para la salud humana, y dañinas para la vida.
Situaciones problemas
1. Camilo Estudiante de Biología, toma dos muestras de agua en dos puntos diferentes del río Cali, así: la muestra No. 1 contiene 40 miligramos de sal disueltos en 100 ml de agua, en tanto que la No. 2 contiene 20 miligramos de sal disueltos en 50 ml de agua. Si se pudiera probar el agua de este rio ¿Cuál de las dos muestras de agua presentaría un sabor más salado? Determina la respuesta utilizando como sistema de concentración %
2. Un análisis químico del río Pance y del Lilí arroja los siguientes resultados respectivamente: 5 mg de arsénico en 150 ml de agua y, 4 mg de arsénico en 80 ml de agua. a. ¿Cuál de los ríos tendrá mayor cantidad de arsénico? Justifica tu respuesta. Determina la respuesta utilizando como sistema de concentración ppm
3. Valentina estudiante de la Univalle tomó una muestra de agua en el río Meléndez, y le realizó un análisis químico el cual arrojó los siguientes datos: en 300 gramos de agua hay disuelto 30 gramos de mercurio. El mismo día, recogió una muestra de agua del río Aguacatal, llevo a cabo el mismo análisis químico a esta muestra encontrado que 800 gramos de agua contenía 20 gramos de mercurio. a. ¿Cuál de las dos muestras presenta un mayor grado de contaminación? (densidad del mercurio 13.55 g/cm3). Determina la respuesta utilizando como sistema de concentración %
4.-Los champús son básicamente jabones y detergentes sintéticos que sirven para remover la suciedad y la grasa del cabello, cuyo pH vario de una marca a otra. Así, en un rápido muestreo que incluyo 20 marcas diferentes, se midió el pH de cada uno de ellos y se encontró un pH entre 3,5 y 8,5 con un promedio de 6.5, es decir levemente ácido. Con relación a estos resultados, responde:
a. ¿es realmente importante que la etiqueta del champú indique el pH? Explica
b. Los champús en estudio resultaron ácidos en su mayoría. ¿Por qué crees que la palabra ácido no se usa para promocionar un champú?
c. ¿Cuál es tu actitud como consumidor de productos de higiene o de belleza? ¿Consideras importante asumir una actitud critica frente a la publicidad de estos productos?
d. ¿Qué harías para comprobar los resultados expuestos anteriormente?
Bibliografía
Hipertexto Química 1. Santillana.
https://contenidosparaaprender.colombiaaprende.edu.co
Investiguemos 10 Química. Editorial Voluntad
Foro
Acceso a las actividades
| Actividad | Nombre | Fecha de ingreso | Fecha de actualización | Número de ingresos | Año | Curso | Subreporte |
|---|---|---|---|---|---|---|---|
No results found. | |||||||
