| Tema | GASES. PROPIEDADES Y LEYES |
|---|---|
| Evidencia | |
| calificable? | 0 |
| Activo | 0 |
Propósito
Que el estudiante aplique en diferentes actividades, las características, propiedades y leyes que rigen a los gases, con el fin de ampliar el concepto de estos y contribuir en la reducción de los agentes contaminantes atmosféricos.
Motivación
Explica lo que es el efecto invernadero y sus efectos sobre la tierra
¿Qué tipos de gases contaminan la atmosfera y de que manera lo hacen?
Explicación
El estado gaseoso
Los gases intervienen en muchos aspectos de nuestra vida cotidiana, ya sea de manera positiva ayudándonos en nuestras labores, o de manera negativa perjudicando nuestro medio ambiente, así por ejemplo:
el aire que respiramos, que nos proporciona el oxígeno que requerimos para respirar y mantenernos vivos,
el GNV o gas natural vehicular, proveniente del gas de Camisea, que permite que los vehículos se movilicen con una menor inversión en combustible,
el gas propano que usamos en casa para preparar los alimentos o calentar el agua de la terma,
el aire presente en las llantas de algunos vehículos,
la mezcla gaseosa que se usan en las soldaduras, formada por acetileno combinado con oxígeno,
el aire enriquecido que se emplea en submarinismo, son mezclas que además de oxígeno contienen helio, nitrógeno,
los gases que se emanan junto con la lava en las erupciones volcánicas,
los gases que se desprenden de los tubos de escape de los vehículos o de las chimeneas de las fábricas, y que contaminan nuestro ambiente.
Las características que define a los gases son:
pueden ser confinados en un recipiente, ocupando todo el volumen del que disponen y adquiriendo la forma del recipiente que los contiene,
son altamente compresibles,
se combinan fácilmente cuando varios gases se confinan en un mismo recipiente,
sus densidades son mucho menores que las de los sólidos y los líquidos;
Son cuatro los parámetros que definen el comportamiento de las sustancias en el estado gaseoso: la presión, P, el volumen, V, la temperatura, T y la cantidad de sustancia en estudio, n. Todos estos parámetros están relacionados entre sí en base a las teorías de los gases ideales.
Se consideran gases a aquellas sustancias que a condiciones normales, existen naturalmente en el estado gaseoso, mientras que cuando una sustancia, líquido o sólido, se evapora, se dice que se encuentra en fase gas. En la siguiente tabla se muestran algunos gases y sus propiedades.
La presión de un gas se define como la fuerza que ejercen las moléculas gaseosas sobre las paredes del recipiente que las contiene. Esta fuerza se produce por el movimiento permanente de las moléculas gaseosas en el interior del recipiente, que colisionan entre si y con las paredes.
En consecuencia, la presión de un gas se determina por el número de colisiones que ejercen las moléculas gaseosas, por unidad de área de la pared del recipiente que lo contiene.
Para medir la presión de un gas que se encuentra dentro de un recipiente se usan generalmente manómetros de mercurio, Hg, como se muestran en la figura y que operan de la siguiente manera:
Si la presión del gas es menor que la atmosférica, se emplea un manómetro de tubo cerrado. En este caso la presión es simplemente la diferencia entre los dos niveles, en mm de Hg (h1)
Si la presión del gas es algo mayor o menor que la atmosférica, se emplea un manómetro de tubo abierto. En este caso la diferencia de en los niveles de Hg indican la diferencia de presión respecto a la presión atmosférica de referencia.
Recuerda
La unidad que usamos comúnmente para la presión, son las atmósferas, atm, aquí algunas de sus equivalencias:
1 atm = 101 325 Pa
1 atm = 1,01325 bar
1 atm = 14,69594877551 PSI (pounds per square inch o libra por pulgada cuadrada)
¿Sabes ...
cómo se mide la presión atmosférica? . qué es el barómetro? para qué sirve el manómetro?
observar los videos y diapositivas para fortalecer conceptos
https://drive.google.com/file/d/1o1M3uFnsFgai_2mYn...
Leyes de los gases ideales
Gas ideal: es el comportamiento que presentan aquellos gases cuyas moléculas no interactúan entre si y se mueven aleatoriamente. En condiciones normales y en condiciones estándar, la mayoría de los gases presentan comportamiento de gases ideales.
Ley de Boyle
Si se reduce la presión sobre un globo, éste se expande, es decir aumenta su volumen, siendo ésta la razón por la que los globos meteorológicos se expanden a medida que se elevan en la atmósfera. Por otro lado, cuando un volumen de un gas se comprime, la presión del gas aumenta. El químico Robert Boyle (1627 - 1697) fue el primero en investigar la relación entre la presión de un gas y su volumen.
La ley de Boyle, que resume estas observaciones, establece que: el volumen de una determinada cantidad de gas, que se mantiene a temperatura constante, es inversamente proporcional a la presión que ejerce, lo que se resume en la siguiente expresión:
P.V = constante o P = 1 / V
y se pueden representar gráficamente como:
La forma que más utilizamos para representar la Ley de Boyle corresponde a la primera gráfica, donde se muestra a un rama de una hipérbola equilátera y podemos usar la siguiente expresión para determinar los valores de dos puntos de la gráfica:
P1 . V1 = P2 . V2
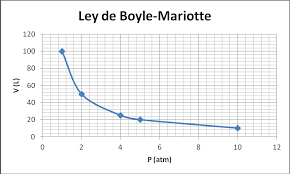
Este tipo de gráficos se denominan isotermas, por lo que a los procesos que cumplen con la Ley de Boyle se les denomina procesos isotérmicos..
Ley de Charles -Gay Lussac: Cuando se calienta el aire contenido en los globos aerostáticos éstos se elevan, porque el gas se expande. El aire caliente que está dentro del globo es menos denso que el aire frío del entorno, a la misma presión, la diferencia de densidad hace que el globo ascienda. Similarmente, si un globo se enfría, éste se encoge, reduce su volumen. La relación entre la temperatura y el volumen fue enunciada por el científico francés J. Charles (1746 - 1823), utilizando muchos de los experimentos realizados por J. Gay Lussac (1778 - 1823).
La ley de Charles y Gay Lussac se resume en: el volumen de una determinada cantidad de gas que se mantiene a presión constante, es directamente proporcional a su temperatura absoluta, que se expresa como:
y gráficamente se representa como:

Debemos tener presente que la temperatura se DEBE expresar en grados Kelvin, K. Para determinar los valores entre dos puntos cualesquiera de la recta podemos usar:
Los procesos que se realizan a presión constante se denominan procesos isobáricos
Análogamente, la presión de una determinada cantidad de gas que se mantiene a volumen constante, es directamente proporcional a su temperatura absoluta, que se expresa como:
Los procesos que se producen a volumen constante se denominan procesos isocóricos.
Ley Combinada de los gases o ley de los cambios triples: Al combinar las leyes mencionadas se obtiene la ley combinada de los gases ideales o ley de los cambios triples, que establece que para una determinada cantidad de gas se cumple:
P.V/T = K . Para determinar los valores entre dos estados diferentes podemos emplear:
P1V1/T1 = P2V2/T2
Recuerda:
En las leyes estudiadas se debe mantener constante el número de moles del gas en estudio.
Es necesario trabajar en temperatura absoluta, es decir en grados Kelvin, K.
Ley de Avogadro
A medida que agregamos gas a un globo, éste se expande, por lo tanto el volumen de un gas depende no sólo de la presión y la temperatura, sino también de la cantidad de gas.
La relación entre la cantidad de un gas y su volumen fue enunciada por Amadeus Avogadro (1778 - 1850), después de los experimentos realizados años antes por Gay - Lussac.
La ley de Avogadro establece que el volumen de un gas mantenido a temperatura y presión constantes, es directamente proporcional al número de moles del gas presentes:
V/n = K Para determinar los valores para dos estados diferentes podemos usar:
V1/n1 = V2/n2
También podemos expresarlo en términos de: la presión de un gas mantenido a temperatura y volumen constantes, es directamente proporcional al número de moles del gas presentes:
P1/n1 = P2/n2
Observación Los experimentos demostraron que a condiciones TPE, 1 mol de una sustancia gaseosa cualquiera, ocupa un volumen de 22,4 L.
Ley general del gas ideal
Las leyes que hemos estudiado se cumplen cuando se trabaja a bajas presiones y temperaturas moderadas. Tenemos que:
Propiedades que se mantienen constantes | Ley | Expresión | |
moles, n | temperatura, T | Boyle | P.V = constante |
moles, n | presión, P | Charles | V / T = constante |
presión, P | temperatura, T | Avogadro | V / n = constante |
Cuando estas leyes se combinan en una sola ecuación, se obtiene la denominada ecuación general de los gases ideales:
P V = n R T
donde la nueva constante de proporcionalidad se denomina R, constante universal de los gases ideales, que tiene el mismo valor para todas las sustancias gaseosas. El valor numérico de R dependerá de las unidades en las que se trabajen las otras propiedades, P, V, T y n. En consecuencia, debemos tener cuidado al elegir el valor de R que corresponda a los cálculos que estemos realizando, así tenemos:
Valor de R | Unidades |
0,082 | |
8,314 | |
1,987 |
Observación Los gases tienen un comportamiento ideal cuando se encuentran a bajas presiones y temperaturas moderadas, en las cuales se mueven lo suficientemente alejadas unas de otras, de modo que se puede considerar que sus moléculas no interactúan entre si (no hay acción de las fuerzas intermoleculares).
Como hemos observado, son cuatro (4) las propiedades que definen el estado o las condiciones en las que se encuentra una sustancia en estado gaseoso: la cantidad de sustancia o número de moles, n; la presión que ejercen sus moléculas, P; la temperatura a la que se encuentra, T y el volumen que ocupa, V. Estas propiedades pueden variar todas simultáneamente o se pueden mantener constantes una o dos de ellas a fin de cambiar las otras
Desarrolle las actividades propuestas en las diapositivas.
https://drive.google.com/file/d/1o1M3uFnsFgai_2mYn...
Ejercicios
ACTIVIDAD
1. Una muestra de gas ocupa 0,250 L bajo una presión de 0,85 atm.Si la temperatura se mantiene constante, ¿qué volumen ocupará la muestra bajo la presión de 1 atm? R= 212,5 ml
2. Si la temperatura de 2 lt de un gas que inicialmente se encontraba a 1 atm y 0° C cambia a 200°C y el volumen se mantiene constante. Calcular la presión del gas en torr.
3.Un gas ocupa un volumen de 4 lt a 27°C.¿A qué temperatura, en grados Celcius el volumen será de 6 lt, si la presión permanece constante?
4. Por medio de un mapa conceptual explique las propiedades de los gases. Ejemplifique con dibujos
5. Explique la teoría cinética molecular de los gases.
6.Explique cada una de las leyes de los gases con ejemplos.
7.En que consiste el principio de Avogadro. Explíquelo y de ejemplos
8. Que diferencia hay entre los gases nobles y los gases reales.
9. Que diferencia hay entre un proceso Isotérmica, Isobárico e Isocorico.
10 Desarrolle las actividades propuestas en las diapositivas.
Evaluación
desarrolle la siguientte acividad interactiva y envié las evidencias
https://www.cerebriti.com/juegos-de-ciencias/leyes-de-los-gases--fisico-quimica-
Bibliografía
Atkins, P. y Jones, L. “Principios de Química. Los caminos del descubrimiento”. Editorial Panamericana. 2006.
2. Atkins, P. y Jones, L. “Química. Moléculas. Materia. Cambio”. Ediciones Omega S.A. Barcelona. España. 1998
3. Brown, T., LeMay, H., Bursten, B. “Química la Ciencia Central”. Prentice Hall Hispanoamericana S.A. México. 1998.
4. Burns. “Fundamentos de Química”. Prentice Hall. 1996.
Foro
¿Por qué la atmósfera ha sido tan determinante para que prosperara y evolucionara la vida en la tierra?
ForoCursos
| Curso | |
|---|---|
No results found. | |
Acceso a las actividades
| Actividad | Nombre | Fecha de ingreso | Fecha de actualización | Número de ingresos | Año | Curso | Subreporte |
|---|---|---|---|---|---|---|---|
| 11899 | Oviedo Rojas Martha Liliana | 2021-11-18 13:14:36 | 2021-11-23 00:30:47 | 2 | 2021 | Propósito | |
| 11899 | Oviedo Rojas Martha Liliana | 2021-11-18 13:14:39 | 2021-11-24 09:26:57 | 3 | 2021 | Motivación | |
| 11899 | Oviedo Rojas Martha Liliana | 2021-11-18 13:14:48 | 2021-11-23 00:30:51 | 2 | 2021 | Explicación | |
| 11899 | Oviedo Rojas Martha Liliana | 2021-11-18 13:15:02 | 2021-11-25 15:25:20 | 6 | 2021 | Ejercicios | |
| 11899 | Oviedo Rojas Martha Liliana | 2021-11-25 16:09:26 | 2021-11-29 08:49:25 | 5 | 2021 | Tarea | |
| 11899 | Oviedo Rojas Martha Liliana | 2021-11-23 00:31:49 | 2021-11-24 09:27:17 | 2 | 2021 | Foro | |
| 11899 | GONZALEZ GARRIDO ANDRES LEONARDO | 2022-02-20 13:46:56 | 2022-02-20 13:46:58 | 2 | 2022 | Motivación | |
| 11899 | AGUILAR VARON SERGIO ALEJANDRO | 2021-11-15 17:42:19 | 2021-11-15 18:04:12 | 4 | 2021 | Ejercicios | |
| 11899 | AGUILAR VARON SERGIO ALEJANDRO | 2021-11-22 10:49:33 | 2021-11-22 10:49:33 | 1 | 2021 | Tarea | |
| 11899 | ALVAREZ PEÑA PAULA KATHERINE | 2021-11-17 07:07:30 | 2021-11-17 07:07:31 | 2 | 2021 | Explicación | |
| 11899 | ALVAREZ PEÑA PAULA KATHERINE | 2021-11-16 09:00:53 | 2021-11-17 07:07:32 | 4 | 2021 | Ejercicios | |
| 11899 | BUSTOS TORRES SERGIO ALEJANDRO | 2022-02-02 00:15:06 | 2022-02-02 07:00:29 | 3 | 2021 | Propósito | |
| 11899 | BUSTOS TORRES SERGIO ALEJANDRO | 2022-02-02 00:15:10 | 2022-02-02 07:00:31 | 3 | 2021 | Motivación | |
| 11899 | BUSTOS TORRES SERGIO ALEJANDRO | 2021-11-24 07:48:35 | 2022-02-02 07:00:49 | 10 | 2021 | Explicación | |
| 11899 | BUSTOS TORRES SERGIO ALEJANDRO | 2021-11-09 15:04:05 | 2022-02-02 07:00:25 | 12 | 2021 | Ejercicios | |
| 11899 | BUSTOS TORRES SERGIO ALEJANDRO | 2022-02-02 00:15:35 | 2022-02-02 00:15:35 | 2 | 2021 | Evaluación | |
| 11899 | BUSTOS TORRES SERGIO ALEJANDRO | 2022-02-02 00:15:03 | 2022-02-02 00:15:03 | 1 | 2021 | Bibliografía | |
| 11899 | BUSTOS TORRES SERGIO ALEJANDRO | 2022-02-02 00:15:03 | 2022-02-02 00:15:03 | 1 | 2021 | Foro | |
| 11899 | CAIZA VELEZ CRISTOPHER PAUL | 2021-11-21 17:26:34 | 2022-02-01 21:50:24 | 3 | 2021 | Propósito | |
| 11899 | CAIZA VELEZ CRISTOPHER PAUL | 2021-11-11 15:41:25 | 2022-02-01 22:10:24 | 4 | 2021 | Motivación | |
| 11899 | CAIZA VELEZ CRISTOPHER PAUL | 2021-11-11 15:41:17 | 2022-02-08 17:36:41 | 13 | 2021 | Explicación | |
| 11899 | CAIZA VELEZ CRISTOPHER PAUL | 2021-11-11 15:41:07 | 2022-02-01 21:50:49 | 13 | 2021 | Ejercicios | |
| 11899 | CAIZA VELEZ CRISTOPHER PAUL | 2021-11-11 15:41:32 | 2022-02-01 21:50:54 | 6 | 2021 | Evaluación | |
| 11899 | CAIZA VELEZ CRISTOPHER PAUL | 2021-11-21 17:29:12 | 2021-11-21 17:29:12 | 1 | 2021 | Bibliografía | |
| 11899 | CAIZA VELEZ CRISTOPHER PAUL | 2021-11-21 17:29:13 | 2021-11-27 09:37:57 | 3 | 2021 | Tarea | |
| 11899 | CAIZA VELEZ CRISTOPHER PAUL | 2021-11-21 17:29:14 | 2021-11-21 17:29:23 | 3 | 2021 | Foro | |
| 11899 | DOMINGUEZ JIMENEZ JOSE DANIEL | 2022-02-01 22:24:09 | 2022-02-01 22:24:09 | 1 | 2021 | Propósito | |
| 11899 | DOMINGUEZ JIMENEZ JOSE DANIEL | 2022-02-01 22:25:28 | 2022-02-01 22:25:28 | 1 | 2021 | Explicación | |
| 11899 | DOMINGUEZ JIMENEZ JOSE DANIEL | 2021-11-15 01:17:54 | 2021-11-19 13:14:44 | 3 | 2021 | Ejercicios | |
| 11899 | DOMINGUEZ JIMENEZ JOSE DANIEL | 2022-02-01 22:25:16 | 2022-02-01 22:25:16 | 1 | 2021 | Evaluación | |
| 11899 | IBARRA MURILLO DIANA ROCIO | 2021-11-22 11:06:56 | 2022-02-02 06:09:57 | 2 | 2021 | Propósito | |
| 11899 | IBARRA MURILLO DIANA ROCIO | 2021-11-22 11:07:06 | 2022-02-02 06:10:02 | 4 | 2021 | Motivación | |
| 11899 | IBARRA MURILLO DIANA ROCIO | 2021-11-23 11:47:47 | 2022-02-02 07:20:09 | 9 | 2021 | Explicación | |
| 11899 | IBARRA MURILLO DIANA ROCIO | 2021-11-09 20:30:19 | 2022-02-02 06:10:18 | 10 | 2021 | Ejercicios | |
| 11899 | IBARRA MURILLO DIANA ROCIO | 2021-11-24 11:01:55 | 2021-11-24 11:01:55 | 1 | 2021 | Evaluación | |
| 11899 | IBARRA MURILLO DIANA ROCIO | 2021-11-24 12:30:29 | 2022-02-07 11:13:02 | 4 | 2021 | Tarea | |
| 11899 | MONROY CORREA JAZPLEYDY YULIEN | 2021-11-19 14:53:41 | 2021-11-19 14:54:30 | 2 | 2021 | Explicación | |
| 11899 | MONROY CORREA JAZPLEYDY YULIEN | 2021-11-19 14:28:20 | 2021-11-19 15:39:32 | 3 | 2021 | Ejercicios | |
| 11899 | MONROY CORREA JAZPLEYDY YULIEN | 2021-11-19 14:54:12 | 2021-11-19 14:54:12 | 1 | 2021 | Evaluación | |
| 11899 | MONTOYA RINCON YULI GISELL | 2022-02-01 16:57:51 | 2022-02-01 16:57:51 | 1 | 2021 | Propósito | |
| 11899 | MONTOYA RINCON YULI GISELL | 2022-02-01 16:57:52 | 2022-02-01 21:37:24 | 6 | 2021 | Motivación | |
| 11899 | MONTOYA RINCON YULI GISELL | 2022-02-01 16:56:59 | 2022-02-01 19:02:28 | 3 | 2021 | Explicación | |
| 11899 | MONTOYA RINCON YULI GISELL | 2022-02-01 16:56:57 | 2022-02-01 17:30:05 | 2 | 2021 | Ejercicios | |
| 11899 | MONTOYA RINCON YULI GISELL | 2022-02-01 16:57:21 | 2022-02-01 16:57:21 | 1 | 2021 | Evaluación | |
| 11899 | MONTOYA RINCON YULI GISELL | 2022-02-01 16:57:23 | 2022-02-01 17:30:00 | 2 | 2021 | Bibliografía | |
| 11899 | MONTOYA RINCON YULI GISELL | 2022-02-01 16:57:26 | 2022-02-01 16:57:26 | 1 | 2021 | Tarea | |
| 11899 | MURILLO FLOREZ EVELYN SAMANTHA | 2021-11-26 09:43:25 | 2022-02-01 20:07:18 | 3 | 2021 | Propósito | |
| 11899 | MURILLO FLOREZ EVELYN SAMANTHA | 2021-11-26 20:14:15 | 2022-02-01 20:07:47 | 3 | 2021 | Motivación | |
| 11899 | MURILLO FLOREZ EVELYN SAMANTHA | 2021-11-24 07:52:02 | 2022-02-01 21:37:30 | 5 | 2021 | Explicación | |
| 11899 | MURILLO FLOREZ EVELYN SAMANTHA | 2021-11-26 09:43:32 | 2022-02-01 20:09:47 | 3 | 2021 | Ejercicios | |
| 11899 | MURILLO FLOREZ EVELYN SAMANTHA | 2021-11-26 22:06:10 | 2022-02-01 20:10:46 | 2 | 2021 | Evaluación | |
| 11899 | MURILLO FLOREZ EVELYN SAMANTHA | 2022-02-13 22:45:37 | 2022-02-13 22:45:37 | 1 | 2021 | Bibliografía | |
| 11899 | MURILLO FLOREZ EVELYN SAMANTHA | 2021-11-30 16:57:02 | 2022-02-13 22:45:38 | 2 | 2021 | Tarea | |
| 11899 | NOREÑA RAMIREZ RUBEN SANTIAGO | 2021-11-24 10:54:38 | 2022-02-01 20:54:08 | 5 | 2021 | Propósito | |
| 11899 | NOREÑA RAMIREZ RUBEN SANTIAGO | 2021-11-24 10:54:40 | 2022-02-01 20:54:06 | 7 | 2021 | Motivación | |
| 11899 | NOREÑA RAMIREZ RUBEN SANTIAGO | 2021-11-24 10:54:49 | 2022-02-01 20:37:51 | 7 | 2021 | Explicación | |
| 11899 | NOREÑA RAMIREZ RUBEN SANTIAGO | 2021-11-24 10:54:54 | 2022-02-01 19:54:10 | 11 | 2021 | Ejercicios | |
| 11899 | NOREÑA RAMIREZ RUBEN SANTIAGO | 2021-11-24 10:55:29 | 2021-11-27 14:49:06 | 7 | 2021 | Evaluación | |
| 11899 | NOREÑA RAMIREZ RUBEN SANTIAGO | 2021-11-27 14:08:48 | 2021-11-27 14:49:06 | 4 | 2021 | Bibliografía | |
| 11899 | NOREÑA RAMIREZ RUBEN SANTIAGO | 2021-11-27 15:15:02 | 2022-02-01 20:54:21 | 4 | 2021 | Tarea | |
| 11899 | NOREÑA RAMIREZ RUBEN SANTIAGO | 2022-02-01 17:47:25 | 2022-02-01 17:47:25 | 1 | 2021 | Foro | |
| 11899 | RADA MONTOYA ELIANY | 2021-11-29 08:21:04 | 2022-02-06 17:56:21 | 4 | 2021 | Propósito | |
| 11899 | RADA MONTOYA ELIANY | 2021-11-29 08:21:07 | 2022-02-06 19:08:36 | 6 | 2021 | Motivación | |
| 11899 | RADA MONTOYA ELIANY | 2021-11-12 11:18:24 | 2022-02-06 17:57:32 | 5 | 2021 | Explicación | |
| 11899 | RADA MONTOYA ELIANY | 2021-11-12 11:18:30 | 2022-02-06 17:57:41 | 8 | 2021 | Ejercicios | |
| 11899 | RADA MONTOYA ELIANY | 2022-02-06 17:57:59 | 2022-02-06 17:58:03 | 2 | 2021 | Evaluación | |
| 11899 | RADA MONTOYA ELIANY | 2022-02-06 17:58:04 | 2022-02-06 17:58:06 | 2 | 2021 | Bibliografía | |
| 11899 | RADA MONTOYA ELIANY | 2021-12-09 11:40:23 | 2022-02-06 17:58:08 | 3 | 2021 | Tarea | |
| 11899 | RADA MONTOYA ELIANY | 2022-02-06 17:58:10 | 2022-02-06 17:58:17 | 2 | 2021 | Foro | |
| 11899 | RAMIREZ QUIÑONES JENIFFER JULIETH | 2022-02-01 18:56:04 | 2022-02-06 16:20:21 | 8 | 2021 | Propósito | |
| 11899 | RAMIREZ QUIÑONES JENIFFER JULIETH | 2022-02-01 18:56:05 | 2022-02-06 16:20:45 | 9 | 2021 | Motivación | |
| 11899 | RAMIREZ QUIÑONES JENIFFER JULIETH | 2021-11-26 18:08:28 | 2022-02-06 16:20:53 | 14 | 2021 | Explicación | |
| 11899 | RAMIREZ QUIÑONES JENIFFER JULIETH | 2021-11-26 18:08:39 | 2022-02-06 16:21:45 | 6 | 2021 | Ejercicios | |
| 11899 | RIASCOS SIERRA JUAN MANUEL | 2021-11-24 20:58:20 | 2022-02-02 04:54:15 | 5 | 2021 | Propósito | |
| 11899 | RIASCOS SIERRA JUAN MANUEL | 2021-11-24 20:58:22 | 2022-02-02 04:54:17 | 7 | 2021 | Motivación | |
| 11899 | RIASCOS SIERRA JUAN MANUEL | 2021-11-24 20:58:23 | 2021-11-27 14:01:27 | 3 | 2021 | Explicación | |
| 11899 | RIASCOS SIERRA JUAN MANUEL | 2021-11-24 20:58:29 | 2022-02-02 04:54:30 | 8 | 2021 | Ejercicios | |
| 11899 | RIASCOS SIERRA JUAN MANUEL | 2021-11-24 20:58:34 | 2022-02-02 04:54:31 | 6 | 2021 | Evaluación | |
| 11899 | RIASCOS SIERRA JUAN MANUEL | 2022-02-02 04:34:54 | 2022-02-02 04:54:32 | 2 | 2021 | Bibliografía | |
| 11899 | RIASCOS SIERRA JUAN MANUEL | 2021-11-24 20:58:37 | 2022-02-02 04:54:34 | 3 | 2021 | Tarea | |
| 11899 | RIASCOS SIERRA JUAN MANUEL | 2021-11-24 20:58:38 | 2022-02-02 04:54:35 | 3 | 2021 | Foro | |
| 11899 | ROJAS PIRAZAN LINDA MARIANA | 2021-11-29 15:06:38 | 2021-11-29 15:06:38 | 1 | 2021 | Propósito | |
| 11899 | ROJAS PIRAZAN LINDA MARIANA | 2021-11-29 15:06:39 | 2021-11-29 15:06:39 | 1 | 2021 | Motivación | |
| 11899 | ROJAS PIRAZAN LINDA MARIANA | 2021-11-29 15:06:52 | 2021-11-29 15:06:52 | 1 | 2021 | Explicación | |
| 11899 | ROJAS PIRAZAN LINDA MARIANA | 2021-11-29 15:07:05 | 2021-11-29 15:07:05 | 1 | 2021 | Ejercicios | |
| 11899 | SAENZ ORJUELA LAURA MARITZA | 2022-02-01 22:26:01 | 2022-02-01 22:26:01 | 1 | 2021 | Propósito | |
| 11899 | SAENZ ORJUELA LAURA MARITZA | 2022-02-01 22:25:53 | 2022-02-01 22:25:53 | 1 | 2021 | Motivación | |
| 11899 | SAENZ ORJUELA LAURA MARITZA | 2022-02-01 22:26:09 | 2022-02-01 22:26:09 | 1 | 2021 | Explicación | |
| 11899 | SAENZ ORJUELA LAURA MARITZA | 2022-02-01 22:25:30 | 2022-02-01 22:25:30 | 1 | 2021 | Ejercicios | |
| 11899 | SAENZ ORJUELA LAURA MARITZA | 2021-11-29 18:12:12 | 2021-11-29 18:12:12 | 1 | 2021 | Evaluación | |
| 11899 | SAENZ ORJUELA LAURA MARITZA | 2021-11-29 18:12:33 | 2021-11-29 18:12:33 | 1 | 2021 | Tarea | |
| 11899 | SERRATO RAMIREZ ALISON ARIANA | 2021-11-17 18:59:06 | 2022-02-07 11:18:12 | 4 | 2021 | Motivación | |
| 11899 | SERRATO RAMIREZ ALISON ARIANA | 2022-02-01 19:11:54 | 2022-02-07 11:18:20 | 2 | 2021 | Explicación | |
| 11899 | SERRATO RAMIREZ ALISON ARIANA | 2021-11-14 19:55:20 | 2022-02-02 06:20:11 | 5 | 2021 | Ejercicios | |
| 11899 | SERRATO RAMIREZ ALISON ARIANA | 2021-11-29 08:19:25 | 2021-11-29 08:19:25 | 1 | 2021 | Evaluación | |
| 11899 | SERRATO RAMIREZ ALISON ARIANA | 2021-11-29 18:15:36 | 2022-02-01 19:00:17 | 3 | 2021 | Tarea | |
| 11899 | MUÑOZ MUÑOZ PAOOL CRISTIAN | 2021-11-19 21:52:32 | 2021-11-19 21:52:32 | 1 | 2021 | Ejercicios | |
| 11899 | MUÑOZ MUÑOZ PAOOL CRISTIAN | 2021-11-29 10:04:38 | 2021-11-29 10:04:38 | 1 | 2021 | Tarea | |
| 11899 | PUENTES HOMEZ ANGELICA JULIETH | 2022-02-28 16:52:15 | 2022-02-28 16:52:19 | 2 | 2022 | Propósito | |
| 11899 | PUENTES HOMEZ ANGELICA JULIETH | 2022-02-28 16:52:07 | 2022-02-28 16:52:07 | 1 | 2022 | Motivación | |
| 11899 | PUENTES HOMEZ ANGELICA JULIETH | 2022-02-28 16:52:21 | 2022-02-28 16:52:21 | 1 | 2022 | Explicación | |
| 11899 | PUENTES HOMEZ ANGELICA JULIETH | 2022-02-28 16:52:50 | 2022-02-28 16:52:50 | 1 | 2022 | Ejercicios | |
| 11899 | HERRERA BERMUDEZ LAURA DANIELA | 2022-02-01 17:37:20 | 2022-02-01 19:24:04 | 2 | 2021 | Motivación | |
| 11899 | HERRERA BERMUDEZ LAURA DANIELA | 2022-02-01 19:24:12 | 2022-02-01 19:24:12 | 1 | 2021 | Explicación | |
| 11899 | PEREZ OSPINA JULIETH TATIANA | 2022-03-15 23:35:00 | 2022-03-15 23:35:02 | 2 | 2022 | Ejercicios | |
| 11899 | PEREZ OSPINA JULIETH TATIANA | 2022-03-16 16:51:30 | 2022-03-16 16:57:19 | 2 | 2022 | Evaluación | |
| 11899 | AGUDELO ÑUSTES NEYI MICHELL | 2021-11-26 07:09:10 | 2022-02-06 21:19:54 | 7 | 2021 | Propósito | |
| 11899 | AGUDELO ÑUSTES NEYI MICHELL | 2022-01-31 15:10:14 | 2022-01-31 15:10:14 | 1 | 2021 | Motivación | |
| 11899 | AGUDELO ÑUSTES NEYI MICHELL | 2022-02-01 23:19:49 | 2022-02-01 23:19:49 | 1 | 2021 | Explicación | |
| 11899 | AGUDELO ÑUSTES NEYI MICHELL | 2022-02-06 21:22:41 | 2022-02-06 21:22:41 | 1 | 2021 | Ejercicios | |
| 11899 | AGUDELO ÑUSTES NEYI MICHELL | 2021-11-26 07:09:58 | 2021-11-26 07:09:58 | 1 | 2021 | Bibliografía | |
| 11899 | AGUDELO ÑUSTES NEYI MICHELL | 2022-02-06 21:24:26 | 2022-02-06 21:24:26 | 1 | 2021 | Tarea | |
| 11899 | BAUTISTA BUITRAGO CRISTIAN STIVEN | 2022-02-01 13:53:56 | 2022-02-01 13:53:56 | 1 | 2021 | Propósito | |
| 11899 | BAUTISTA BUITRAGO CRISTIAN STIVEN | 2022-02-01 13:54:01 | 2022-02-01 14:05:27 | 3 | 2021 | Motivación | |
| 11899 | BAUTISTA BUITRAGO CRISTIAN STIVEN | 2022-02-01 13:54:21 | 2022-02-01 18:48:29 | 4 | 2021 | Explicación | |
| 11899 | BAUTISTA BUITRAGO CRISTIAN STIVEN | 2022-02-01 13:53:25 | 2022-02-01 18:48:59 | 4 | 2021 | Ejercicios | |
| 11899 | BAUTISTA BUITRAGO CRISTIAN STIVEN | 2022-02-01 13:53:23 | 2022-02-01 13:53:23 | 1 | 2021 | Evaluación | |
| 11899 | BAUTISTA BUITRAGO CRISTIAN STIVEN | 2022-02-01 13:53:21 | 2022-02-01 18:48:21 | 2 | 2021 | Tarea | |
| 11899 | CASTILLO MARIN JENNIFER ALEXANDRA | 2022-02-01 17:05:44 | 2022-02-01 17:05:44 | 1 | 2021 | Propósito | |
| 11899 | CASTILLO MARIN JENNIFER ALEXANDRA | 2022-02-01 17:05:50 | 2022-02-01 17:05:50 | 1 | 2021 | Motivación | |
| 11899 | CASTILLO MARIN JENNIFER ALEXANDRA | 2022-01-31 13:29:06 | 2022-02-06 18:27:33 | 4 | 2021 | Explicación | |
| 11899 | CASTILLO MARIN JENNIFER ALEXANDRA | 2022-01-31 13:28:58 | 2022-01-31 13:28:58 | 1 | 2021 | Ejercicios | |
| 11899 | GARCIA GUZMAN ASHLY NICOLE | 2022-02-01 16:22:56 | 2022-02-01 16:37:30 | 5 | 2021 | Propósito | |
| 11899 | GARCIA GUZMAN ASHLY NICOLE | 2022-02-01 16:23:01 | 2022-02-01 17:34:59 | 7 | 2021 | Motivación | |
| 11899 | GARCIA GUZMAN ASHLY NICOLE | 2021-11-10 12:20:26 | 2022-02-01 18:42:00 | 4 | 2021 | Explicación | |
| 11899 | GARCIA GUZMAN ASHLY NICOLE | 2021-11-10 11:23:20 | 2022-02-01 16:25:35 | 4 | 2021 | Ejercicios | |
| 11899 | GONZALEZ ARBELAEZ ELIAN FABIAN | 2022-02-01 14:09:40 | 2022-02-01 19:58:28 | 2 | 2021 | Propósito | |
| 11899 | GONZALEZ ARBELAEZ ELIAN FABIAN | 2022-02-01 14:09:43 | 2022-02-01 21:40:21 | 3 | 2021 | Motivación | |
| 11899 | GONZALEZ ARBELAEZ ELIAN FABIAN | 2021-11-17 07:59:29 | 2022-02-01 21:40:41 | 8 | 2021 | Explicación | |
| 11899 | GONZALEZ ARBELAEZ ELIAN FABIAN | 2021-11-17 07:59:41 | 2022-02-01 21:40:41 | 5 | 2021 | Ejercicios | |
| 11899 | GONZALEZ ARBELAEZ ELIAN FABIAN | 2022-02-01 21:40:41 | 2022-02-01 21:40:41 | 1 | 2021 | Bibliografía | |
| 11899 | MATEUS CANTOR KATERIN MILENA | 2022-02-01 17:47:24 | 2022-02-06 17:51:55 | 4 | 2021 | Propósito | |
| 11899 | MATEUS CANTOR KATERIN MILENA | 2022-02-01 17:47:23 | 2022-02-02 06:14:36 | 3 | 2021 | Motivación | |
| 11899 | MATEUS CANTOR KATERIN MILENA | 2022-02-01 17:47:28 | 2022-02-06 19:58:28 | 2 | 2021 | Explicación | |
| 11899 | MATEUS CANTOR KATERIN MILENA | 2022-02-01 22:46:40 | 2022-02-06 20:11:06 | 2 | 2021 | Ejercicios | |
| 11899 | MATEUS CANTOR KATERIN MILENA | 2022-02-06 17:01:48 | 2022-02-06 17:49:06 | 3 | 2021 | Tarea | |
| 11899 | MELLADO PERDOMO SHELCY LLUVIGSA | 2021-11-20 22:02:28 | 2021-11-20 22:02:29 | 2 | 2021 | Propósito | |
| 11899 | MELLADO PERDOMO SHELCY LLUVIGSA | 2021-11-20 22:02:24 | 2021-11-20 22:02:35 | 7 | 2021 | Motivación | |
| 11899 | MELLADO PERDOMO SHELCY LLUVIGSA | 2021-11-20 22:02:36 | 2021-11-20 22:10:23 | 4 | 2021 | Explicación | |
| 11899 | MELLADO PERDOMO SHELCY LLUVIGSA | 2021-11-17 14:53:43 | 2021-11-21 17:19:16 | 8 | 2021 | Ejercicios | |
| 11899 | MELLADO PERDOMO SHELCY LLUVIGSA | 2021-11-17 14:57:15 | 2021-11-17 14:57:15 | 1 | 2021 | Evaluación | |
| 11899 | MELLADO PERDOMO SHELCY LLUVIGSA | 2021-11-17 14:57:13 | 2021-11-17 14:57:16 | 2 | 2021 | Bibliografía | |
| 11899 | MELLADO PERDOMO SHELCY LLUVIGSA | 2021-11-21 20:52:24 | 2021-11-21 20:52:24 | 1 | 2021 | Tarea | |
| 11899 | MOLINA OSPINA MARIANA | 2021-11-16 10:34:40 | 2021-11-16 10:34:40 | 1 | 2021 | Ejercicios | |
| 11899 | MOLINA OSPINA SANTIAGO | 2021-12-03 10:44:40 | 2021-12-03 10:44:40 | 1 | 2021 | Ejercicios | |
| 11899 | MONTEALEGRE BONILLA GLORIA DANIELA | 2021-11-28 12:13:23 | 2021-11-28 12:13:23 | 1 | 2021 | Propósito | |
| 11899 | MONTEALEGRE BONILLA GLORIA DANIELA | 2022-02-04 17:11:06 | 2022-02-04 17:11:06 | 1 | 2021 | Motivación | |
| 11899 | MONTEALEGRE BONILLA GLORIA DANIELA | 2022-02-04 17:11:26 | 2022-02-04 17:11:26 | 6 | 2021 | Evaluación | |
| 11899 | MONTEALEGRE BONILLA GLORIA DANIELA | 2022-02-04 17:11:26 | 2022-02-04 17:11:26 | 1 | 2021 | Bibliografía | |
| 11899 | MONTEALEGRE BONILLA GLORIA DANIELA | 2021-11-24 23:07:58 | 2022-02-04 17:16:43 | 6 | 2021 | Tarea | |
| 11899 | MUÑOZ ORTIZ FABIAN ANDRES | 2022-02-01 22:15:29 | 2022-02-01 22:15:29 | 1 | 2021 | Propósito | |
| 11899 | MUÑOZ ORTIZ FABIAN ANDRES | 2022-02-01 22:16:02 | 2022-02-01 23:17:46 | 3 | 2021 | Motivación | |
| 11899 | PUENTES HOMEZ ANGELICA JULIETH | 2021-11-17 11:09:37 | 2022-02-06 20:41:56 | 5 | 2021 | Motivación | |
| 11899 | PUENTES HOMEZ ANGELICA JULIETH | 2021-11-23 22:19:56 | 2022-02-06 20:42:27 | 8 | 2021 | Explicación | |
| 11899 | PUENTES HOMEZ ANGELICA JULIETH | 2021-11-17 11:09:32 | 2022-02-06 20:42:28 | 13 | 2021 | Ejercicios | |
| 11899 | PUENTES HOMEZ ANGELICA JULIETH | 2021-11-17 11:09:30 | 2022-02-06 20:24:35 | 18 | 2021 | Tarea | |
| 11899 | PUENTES HOMEZ ANGELICA JULIETH | 2021-11-28 23:09:31 | 2021-11-28 23:09:31 | 1 | 2021 | Foro | |
| 11899 | ROJAS GOMEZ JULIAN SANTIAGO | 2022-02-02 13:11:35 | 2022-02-02 13:11:37 | 2 | 2021 | Propósito | |
| 11899 | ROJAS GOMEZ JULIAN SANTIAGO | 2022-02-02 13:11:37 | 2022-02-02 13:11:41 | 3 | 2021 | Motivación | |
| 11899 | ROJAS GOMEZ JULIAN SANTIAGO | 2022-02-02 13:11:41 | 2022-02-02 13:12:03 | 2 | 2021 | Explicación | |
| 11899 | ROJAS GOMEZ JULIAN SANTIAGO | 2022-02-02 13:12:05 | 2022-02-02 13:12:15 | 4 | 2021 | Ejercicios | |
| 11899 | SARMIENTO ALBINO JUAN FELIPE | 2022-02-02 18:18:01 | 2022-02-02 18:18:01 | 1 | 2021 | Propósito | |
| 11899 | SARMIENTO ALBINO JUAN FELIPE | 2022-02-02 18:18:00 | 2022-02-02 18:18:00 | 1 | 2021 | Motivación | |
| 11899 | SARMIENTO ALBINO JUAN FELIPE | 2022-02-02 18:18:00 | 2022-02-02 18:18:00 | 1 | 2021 | Explicación | |
| 11899 | SARMIENTO ALBINO JUAN FELIPE | 2022-02-02 18:17:59 | 2022-02-02 18:17:59 | 1 | 2021 | Ejercicios | |
| 11899 | VANEGAS ARDILA OSCAR ANDRES | 2022-01-06 09:09:34 | 2022-01-06 09:09:34 | 1 | 2021 | Propósito | |
| 11899 | VANEGAS ARDILA OSCAR ANDRES | 2022-01-27 12:48:03 | 2022-01-27 12:48:03 | 3 | 2021 | Motivación | |
| 11899 | VELASCO CASTILLO HEIDY NATALY | 2021-11-19 13:36:18 | 2021-11-19 13:36:18 | 1 | 2021 | Ejercicios | |
| 11899 | VELASCO CASTILLO HEIDY NATALY | 2021-11-19 13:36:17 | 2021-11-19 13:36:17 | 1 | 2021 | Tarea | |
| 11899 | MUÑOZ RAMON MAIRA FERNANDA | 2022-03-10 10:10:23 | 2022-03-10 10:20:40 | 3 | 2022 | Tarea |
