| Tema | Generalidades de la química |
|---|---|
| Evidencia | Fotografías de los talleres de los estudiantes, llamado a lista, vídeos, listas de chequeo y asistencia, llamado a padres de familia, grupos de WhatsA |
| calificable? | 0 |
| Activo | 1 |
Propósito
GUÍA # 2:
Que el estudiante comprenda el concepto de formulas químicas y la importancia de estas para describir las reacciones químicas.
Motivación
Observa la siguiente infografía y dibújala en tu cuaderno:

Explicación
FORMULAS QUÍMICAS (tema adaptado de: Secundaria Activa-MEN):
Los científicos han desarrollado diferentes formas de representar los compuestos químicos utilizando para ello los símbolos de los elementos químicos. Nosotros también continuamente representamos situaciones de diferentes formas.
En todo el mundo, la molécula de agua se representa mediante la fórmula H2O, es decir, dos átomos de hidrógeno por uno de oxígeno; esto indica que las fórmulas químicas constituyen un lenguaje universal. Una fórmula está constituida por símbolos químicos que indican los elementos que forman un compuesto. Por ejemplo, KCl es la fórmula de cloruro de potasio. Este compuesto está formado por un átomo de potasio y un átomo de cloro. Otro caso es la fórmula del dióxido de azufre, SO2 , la cual está formada por la unión de un átomo de azufre y dos átomos de oxígeno.
Cuando los átomos de los distintos elementos no están en igual número, la relación en la que se encuentran se indica mediante subíndices; por ejemplo, en el SO2 el azufre tiene subíndice 1 (por tener este valor no se escribe) y el oxígeno tiene subíndice 2.
El subíndice es el número colocado a la derecha y en la parte inferior del símbolo que indica el número de átomos de cada elemento presentes en una fórmula química. Al observar una fórmula química se puede conocer tanto los elementos que constituyen un compuesto, como el número de átomos de cada elemento que en él se encuentran.
Si a la fórmula se le antepone un número, llamado coeficiente, éste señala la cantidad de moléculas de un compuesto; por ejemplo, 3H2 O significa que hay 3 moléculas de agua. En estos casos, el coeficiente se escribe más grande que los subíndices.
Existen diferentes tipos de fórmulas: moleculares, empíricas, condensadas, y electrónicas, veamos:
1. FORMULAS CONDENSADAS: Las fórmulas de este tipo indican la cantidad de átomos de cada elemento presentes en un compuesto; por ejemplo, la fórmula condensada del alcohol etílico es C2 H6 O e indica que en una molécula de este alcohol se encuentran 2 átomos de carbono, 6 de hidrógeno y 1 de oxígeno.
2. FORMULAS ESTRUCTURALES::
Estas fórmulas son la representación gráfica de la unión de los átomos para formar una molécula; indican la proporción de átomos y la estructura de la molécula; por ejemplo, la fórmula desarrollada o estructural del C2 H6 O (alcohol de caña o etílico) es:
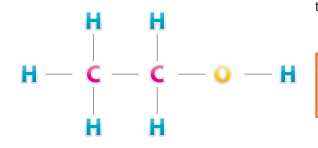
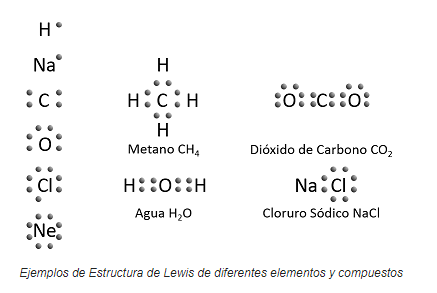
3. FORMULAS ELECTRONICAS:
Son aquellas que representan una molécula incluyendo todos los electrones externos de los átomos que la constituyen, estén o no comprometidos en la unión química. También reciben el nombre de fórmulas de Lewis, en honor al científico que las desarrolló. Los electrones se pueden representar por medio de puntos, círculos o cruces como se ilustra a continuación:

Ejercicios
En tu cuaderno:
1. Explica qué información se puede obtener de una fórmula química, da ejemplos.
Explica que importancia tiene para la industria representar las sustancias o compuestos por medio de fórmulas.
Evaluación
En tu cuaderno:
1. Explica dada una de las formulas químicas y dibuja los ejemplos que están en la guía.
2. Realiza los siguientes ejemplos en tu cuaderno:
Ejemplos de Fórmulas Químicas:
- Peróxido de Hidrógeno:
- Fórmula Molecular ? H2O2
- Fórmula Empírica ? HO
- Fórmula Semidesarrollada ? HO-OH
- Etano:
- Fórmula Molecular ? C2H6
- Fórmula Empírica ? CH3
- Fórmula Semidesarrollada ? CH3-CH3
- Agua:
- Fórmula Molecular ? H2O
- Fórmula Empírica ? H2O
- Fórmula Semidesarrollada ? H-O-H
- Hidrógeno (molecular):
- Fórmula Molecular ? H2
- Fórmula Empírica ? H2
- Fórmula Semidesarrollada ? H-H
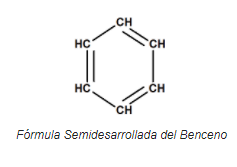
- Benceno:
- Fórmula Molecular ? C6H6
- Fórmula Empírica ? CH
- Fórmula Semidesarrollada
Bibliografía
Foro
Cursos
| Curso | |
|---|---|
No results found. | |
Acceso a las actividades
| Actividad | Nombre | Fecha de ingreso | Fecha de actualización | Número de ingresos | Año | Curso | Subreporte |
|---|---|---|---|---|---|---|---|
No results found. | |||||||
