| Tema | Enlaces |
|---|---|
| Evidencia | |
| calificable? | 1 |
| Activo | 1 |
Propósito
el estudiante reconozca el enlace covalente
Motivación
Explicación
GUIA 01 ENLACE COVALENTE
No todos los átomos ceden o ganan electrones cuando forman enlaces. Un enlace covalente se forma cuando dos átomos comparten uno o más de dos pares de electrones para completar cada uno ocho electrones en su último nivel. En este enlace, no hay formación de iones y se presenta principalmente entre los no metales. Los electrones compartidos en un enlace covalente pertenecen a ambos átomos. Cada par de electrones compartidos se representa por una línea que une los dos símbolos de átomos. Ejemplo: la molécula de agua está formada por dos átomos de hidrógeno y uno de oxígeno (no metales).
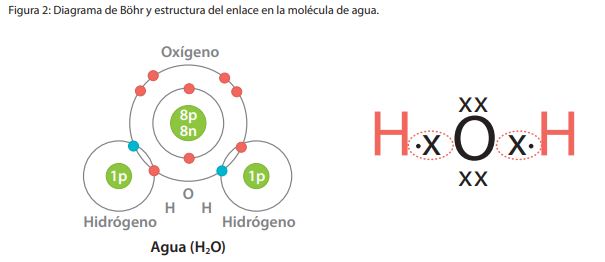
Dependiendo del número de enlaces compartidos, los enlaces covalentes pueden ser simples o sencillos, dobles o triples.
Enlace covalente sencillo: es el que se forma cuando los átomos que se unen comparten un par de electrones; cada átomo aporta un electrón, como en el caso del HCl.
Enlace covalente doble: es el que se forma cuando los átomos que se unen comparten dos pares de electrones; cada átomo aporta un par. Se representa con dos líneas cortas (=). Ejemplo: la molécula de oxígeno.
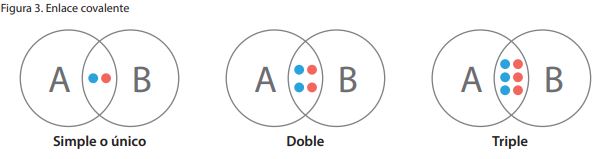
Enlace covalente triple: es el que se forma cuando se comparten tres pares de electrones; cada átomo aporta tres electrones. Su representación es de tres líneas (?).
Ejemplo: la molécula del nitrógeno.
También los enlaces covalentes se diferencian en polar y apolar dependiendo de la electronegatividad de cada átomo
Enlace covalente apolar: cuando las moléculas están formadas por dos átomos iguales, estas no presentan diferencia en la electronegatividad, por lo cual son conocidas como moléculas apolares (sin polos). Los pares de electrones compartidos son atraídos por ambos núcleos con la misma intensidad. También se da el enlace apolar cuando la diferencia de electronegatividad es inferior a 0,5.
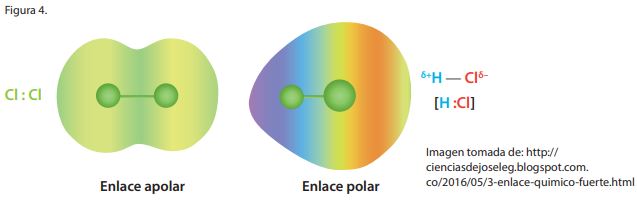
Enlace covalente polar: cuando los átomos se enlazan, tienen una electronegatividad diferente. En la molécula se establece una zona donde se concentra una mayor densidad electrónica, originándose así un polo positivo y uno negativo. Por consiguiente, la zona que pertenece al átomo de mayor electronegatividad, será el polo negativo y la de menor electronegatividad, será la del polo positivo. La diferencia de electronegatividad entre los dos átomos de diferentes elementos del enlace polar debe ser entre 0,5 y 1,6 superior a este valor es un enlace iónico. En la figura se indican las cargas parciales (positiva y negativa) mas no se representa la carga de cada ion. HCl ? H + ?----Cl – ?
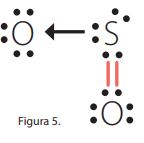
Enlace covalente coordinado: este enlace tiene lugar entre distintos átomos y se caracteriza porque los electrones que se comparten son aportados por uno solo de los átomos que se enlazan. El átomo que aporta el par de electrones se denomina dador y el que lo recibe, receptor. El enlace covalente coordinado se representa por medio de una flecha que parte del átomo que aporta los dos electrones y se dirige hacia el átomo que no aporta ninguno. El SO2 es una molécula en la cual se presenta un enlace covalente doble y dativo.
Ejercicios
Con base en la lectura del texto anterior, responda en su cuaderno las siguientes preguntas: a) ¿Cuántos electrones forman un enlace covalente?
b) ¿Un enlace covalente se forma entre átomos de elementos metálicos o no metálicos?
c) ¿Cuál es la configuración electrónica del hidrógeno y del cloro? ¿Cuántos electrones de valencia tiene cada uno?
d) Dibuje la estructura de Lewis del enlace covalente que hay en HCl.
Evaluación

Bibliografía
Foro
Cursos
| Curso | |
|---|---|
No results found. | |
Acceso a las actividades
| Actividad | Nombre | Fecha de ingreso | Fecha de actualización | Número de ingresos | Año | Curso | Subreporte |
|---|---|---|---|---|---|---|---|
No results found. | |||||||
